6.21: Періодичні тенденції - електронегативність
- Page ID
- 19354
Вам легко чи важко завести нових друзів?
Ви коли-небудь помічали, як одні люди залучають до них інших? Будь то їх особистість, привабливість або спортивні навички - щось тягне людей до них; в той час як інші мають меншу групу друзів і знайомих. Атоми роблять те ж саме. Один атом може сильно тягнути до нього електрони, тоді як другий тип атома має набагато меншу «тягову силу».
Електронегативність
Валентні електрони обох атомів завжди беруть участь, коли ці два атоми збираються разом, утворюючи хімічний зв'язок. Хімічні зв'язки є основою для того, як елементи поєднуються один з одним, утворюючи сполуки. При утворенні цих хімічних зв'язків атоми деяких елементів мають більшу здатність притягувати валентні електрони, що беруть участь в зв'язку, ніж інші елементи.
Електронегативність - це міра здатності атома притягувати електрони, коли атом входить до складу сполуки. Електронегативність відрізняється від спорідненості електронів, оскільки спорідненість електронів - це фактична енергія, що виділяється, коли атом отримує електрон. Електронегативність вимірюється не в одиницях енергії, а замість відносної шкали. Всі елементи порівнюються один з одним, причому найбільш електронегативний елемент - фтор, йому присвоюється значення електронегативності 3,98. Фтор притягує електрони краще, ніж будь-який інший елемент. У таблиці нижче наведені значення електронегативності для елементів.
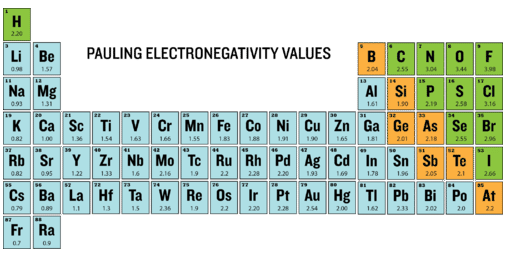
Оскільки метали мають мало валентних електронів, вони, як правило, збільшують свою стабільність, втрачаючи електрони, щоб стати катіонами. Отже, електронегативність металів, як правило, низька. Неметали мають більше валентних електронів і підвищують їх стійкість, отримуючи електрони, щоб стати аніонами. Електронегативність неметалів, як правило, висока.
Тенденції
Електронегативність, як правило, збільшується зліва направо через період. Це пов'язано зі збільшенням ядерного заряду. Лужні метали мають найнижчу електронегативність, в той час як галогени мають найвищу. Оскільки більшість благородних газів не утворюють сполук, вони не мають електронегативності. Зауважимо, що серед перехідних металів мало варіацій. Електронегативність, як правило, зменшується зверху вниз всередині групи, через більший атомний розмір.
З елементів основної групи фтор має найвищу електронегативність (EN\(= 4.0\)), а цезій найнижчу (EN\(= 0.79\)). Це свідчить про те, що фтор має високу тенденцію до отримання електронів від інших елементів з меншою електронегативністю. Ми можемо використовувати ці значення, щоб передбачити, що відбувається, коли певні елементи поєднуються.
Коли різниця між електронегативністю атома більше ~1,7, то відбувається повний обмін електронами. Зазвичай цей обмін відбувається між металом і неметалом. Наприклад, натрій і хлор зазвичай поєднуються, утворюючи нову сполуку, і кожен іон стає ізоелектронним зі своїм найближчим благородним газом. Коли ми порівнюємо значення EN, ми бачимо, що електронегативність для\(\ce{Na}\) дорівнює 0,93, а значення для\(\ce{Cl}\) дорівнює 3,2. Абсолютна різниця між ENS є\(\left| 0.93 - 3.2 \right| = 2.27\). Це значення більше 1,7, а тому свідчить про виникнення повного електронного обміну.
Резюме
- Електронегативність - це міра здатності атома притягувати електрони, коли атом входить до складу сполуки.
- Значення електронегативності, як правило, збільшуються зліва направо по таблиці Менделєєва.
- Електронегативність, як правило, зменшується зверху вниз групи.
- Найвище значення електронегативності - для фтору.
Рецензія
- Визначте «електронегативність».
- Чим електронегативність відрізняється від спорідненості електронів?
- Чому значення електронегативності металів взагалі низькі?
- Опишіть тенденцію електронегативності по таблиці Менделєєва.
- Охарактеризуйте тенденції електронегативності в групі періодичної таблиці.
