6.18: Екранування електронів
Яка мета гри в дербі на роликах?
Роликові дербі - популярний вид спорту, хоча він незнайомий багатьом людям. Основна мета полягає в тому, щоб встановити одного члена команди («перешкод») повз команди суперника, щоб набрати очки. Інші члени команди служать блокаторами, щоб запобігти протиборчій команді від зупинки перешкод. Блокатори перешкоджають взаємодії між перешкодою і противниками, потрапляючи між перешкодою і фігуристів, намагаючись їх зупинити.
Притягання між електроном і ядром атома - питання не з простих. Тільки з воднем існує взаємозв'язок один до одного, про яку можна говорити з точки зору прямого залучення заряду. Зі збільшенням розмірів атома збільшується і кількість протонів і електронів. Ці зміни впливають на те, як ядро притягує електрони.
Екранування електронів
Загалом, енергія іонізації атома буде збільшуватися, коли ми рухаємося зліва направо по таблиці Менделєєва. Є кілька винятків із загального збільшення енергії іонізації протягом певного періоду. Елементи групи 13 (BAl, і ін.) мають більш низькими енергіями іонізаціїBeMg, ніж елементи групи 2 (і ін.). Це ілюстрація концепції під назвою «екранування електронів». Зовнішні електрони частково екрановані від сили притягання протонів в ядрі внутрішніми електронами.
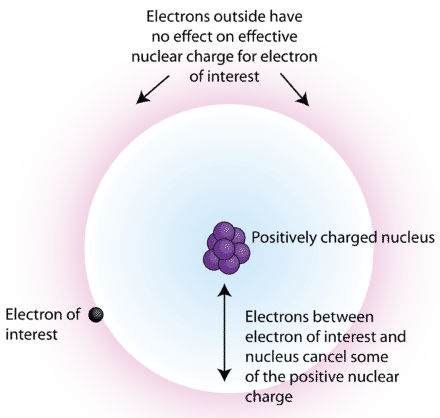
Щоб пояснити, як працює екранування, розглянемо атом літію. Він має три протони та три електрони - два на першому рівні основної енергії та валентний електрон у другому. Валентний електрон частково екранований від сили притягання ядра двома внутрішніми електронами. Видалення цього валентного електрона стає легше через ефект екранування.
Існує також екрануючий ефект, який виникає між підрівнями в межах одного і того ж основного енергетичного рівня. Зокрема, електрон наs підрівні здатний екранувати електрони наp підрівні того ж основного енергетичного рівня. Це відбувається через сферичної формиs орбіти. Зворотне не вірно - електрони наp орбіталі не захищають електрони наs орбіталах.
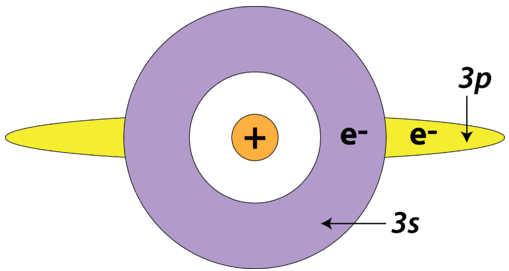
Електрон, що видаляється зAl атома, являє собою3p електрон, який екранований двома3s електронами, а також усіма електронами внутрішнього ядра. Електрон, що видаляється зMg атома, - це3s електрон, який екранований лише внутрішніми ядрами електронів. Оскільки вAl атомі спостерігається більший ступінь екранування електронів, видалити валентний електрон трохи легше; його енергія іонізації менше, ніж уMg. Це при тому, що ядроAl атома містить на один протон більше, ніж ядроMg атома.
Існує ще одна аномалія між групами 15 і 16. Атоми групи 16 (іOS ін.) мають менші енергії іонізаціїN, ніж атоми групи 15 (іP ін.). Правило Гунда стоїть за поясненням. В атомі азоту є три електрони на2p підрівні, і кожен непарний. В атомі кисню на2p підрівні є чотири електрони, тому одна орбіталь містить пару електронів. Це той другий електрон на орбіті, який видаляється при іонізації атома кисню. Так як електрони відштовхують один одного, видалити електрон з парного набору в атомі кисню трохи легше, ніж видалити непарний електрон з атома азоту.
Резюме
- Електронним екрануванням називають блокування притягання електронів валентної оболонки ядром, обумовлене наявністю електронів у внутрішній оболонці.
- Електрони вs орбіталі можутьp захищати електрони на одному енергетичному рівні через сферичну формуs орбіти.
- Електрони в парних спінових конфігураціях трохи легше видалити, ніж непарні електрони.
Рецензія
- Визначте «екранування електронів».
- Чому елементи групи 13 мають меншу енергію іонізації, ніж елементи групи 2?
- Який вплив має більший екрануючий ефект на енергію іонізації?
- Як електрони s орбіти впливають на енергію іонізації p електрона в одній оболонці?
- Чому атоми групи 16 мають меншу енергію іонізації, ніж відповідна група 15 атомів?
