6.15: Періодичні тенденції - атомний радіус
- Page ID
- 19370
Як же всі ці люди можуть поміститися в такому маленькому просторі?
Події притягують до них велику кількість людей. Навіть захід на відкритому повітрі може заповнити так, що немає місця для більшої кількості людей. Місткість натовпу залежить від кількості місця в місці проведення, а кількість простору залежить від розмірів об'єктів, що заповнюють його. Ми можемо отримати більше людей у даний простір, ніж слони, тому що слони більші за людей. Ми можемо отримати більше білок у той самий простір, ніж люди з тієї ж причини. Знання розмірів об'єктів, з якими потрібно мати справу, може бути важливим у вирішенні того, скільки місця потрібно.
Атомний радіус
Розмір атомів важливий для пояснень поведінки атомів або сполук. Одним із способів виразити розмір атомів є використання атомного радіуса. Ці дані допомагають нам зрозуміти, чому деякі молекули поєднуються між собою і чому інші молекули мають частини, які занадто переповнені за певних умов.
Розмір атома визначається краєм його орбіти. Однак орбітальні межі нечіткі і змінні при різних умовах. Для стандартизації вимірювання атомних радіусів вимірюється відстань між ядрами двох однакових атомів, пов'язаних між собою. Атомний радіус визначається як половина відстані між ядрами однакових атомів, які пов'язані між собою.
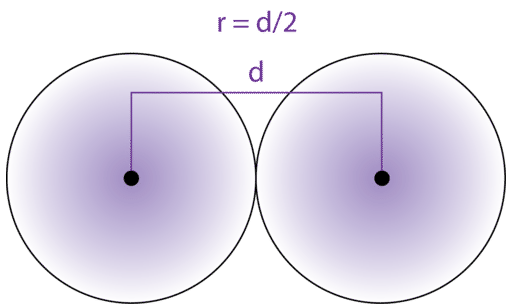
Атомні радіуси були виміряні для елементів. Одиницями для атомних радіусів є пікометри, рівні\(10^{-12}\) метрам. Як приклад, вимірюється міжядерна відстань між двома атомами водню в\(\ce{H_2}\) молекулі\(74 \: \text{pm}\). Тому атомний радіус атома водню є\(\frac{74}{2} = 37 \: \text{pm}\).
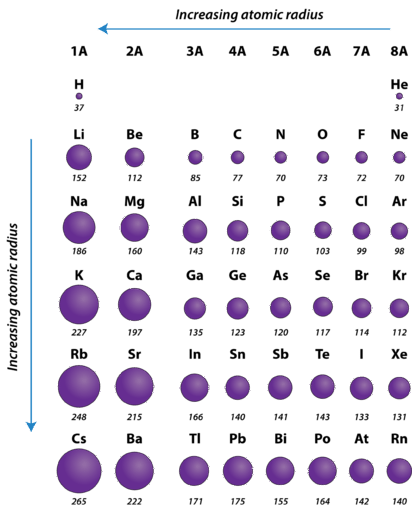
Періодична тенденція
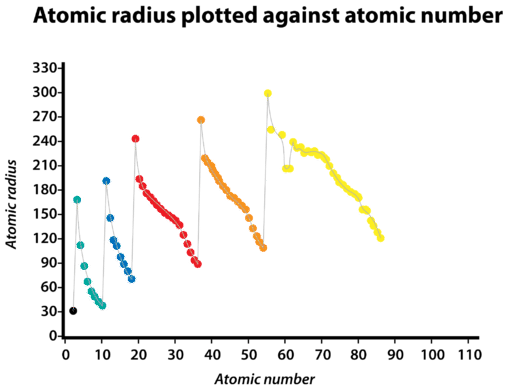
Атомний радіус атомів, як правило, зменшується зліва направо через період. Є деякі невеликі винятки, наприклад, радіус кисню трохи перевищує радіус азоту. Протягом певного періоду протони додаються до ядра, оскільки електрони додаються до того ж основного енергетичного рівня. Ці електрони поступово підтягуються ближче до ядра через його підвищеного позитивного заряду. Так як сила тяжіння між ядрами і електронами збільшується, розмір атомів зменшується. Ефект зменшується, коли людина рухається далі вправо протягом певного періоду, через електронно-електронні відбиття, які в іншому випадку призвели б до збільшення розміру атома.
Груповий тренд
Атомний радіус атомів, як правило, збільшується зверху вниз всередині групи. Коли атомний номер збільшується вниз групи, знову спостерігається збільшення позитивного ядерного заряду. Однак спостерігається також збільшення кількості зайнятих основних енергетичних рівнів. Вищі основні енергетичні рівні складаються з орбіталів, які більші за розміром, ніж орбіталі з нижчих енергетичних рівнів. Ефект більшої кількості основних енергетичних рівнів переважує збільшення ядерного заряду, і тому атомний радіус збільшується вниз по групі.
Резюме
- Атомний радіус визначається як половина відстані між ядрами двох однакових атомів, пов'язаних між собою.
- Атомний радіус атомів, як правило, зменшується зліва направо через період.
- Атомний радіус атомів, як правило, збільшується зверху вниз всередині групи.
Рецензія
- Визначте «атомний радіус».
- Які одиниці виміру атомного радіуса?
- Як змінюється атомний радіус різних елементів протягом періоду?
- Як атомний радіус змінюється зверху вниз всередині групи?
- Поясніть, чому атомний радіус водню настільки менше атомного радіуса калію.