5.5: Спектри атомних викидів
- Page ID
- 19420
Скільки енергії потрібно, щоб стріляти стрілою?
Стрільба з лука як вид спорту або засіб оборони існує століттями. У спокої немає натягу тятиви і сили на стрілку. Коли струна і стріла відтягуються назад, у нас тепер склалася ситуація, коли кінетична енергія (витягування струни) була перетворена в потенційну енергію (натяг на струні). Стрілець звільняє стрілу, і потенційна енергія перетворюється на кінетичну енергію, коли стрілка рухається. Виходить, що електрони поводяться так само, коли енергія потрапляє в систему або вивільняється з системи.
Спектри атомних випромінювань
Електрони в атомі, як правило, розташовані таким чином, що енергія атома була максимально низькою. Підземний стан атома - це найнижчий енергетичний стан атома. Коли ці атоми отримують енергію, електрони поглинають енергію і рухаються на більш високий енергетичний рівень. Ці енергетичні рівні електронів в атомах квантуються, що означає знову ж таки, що електрон повинен рухатися від одного енергетичного рівня до іншого дискретними кроками, а не безперервно. Збуджений стан атома - це стан, коли його потенційна енергія вище, ніж основний стан. Атом в збудженому стані не стійкий. Коли він повертається назад в наземний стан, він вивільняє енергію, яку раніше отримувала у вигляді електромагнітного випромінювання.
Отже, як атоми отримують енергію в першу чергу? Один із способів - пропускати електричний струм через закритий зразок газу при низькому тиску. Оскільки рівні енергії електронів є унікальними для кожного елемента, кожна газорозрядна трубка буде світитися відмінним кольором, залежно від ідентичності газу (див. Нижче).

«Неонові» вивіски - знайомі приклади газорозрядних трубок. Однак тільки ознаки того, що світяться червоно-оранжевим кольором, поміченим на малюнку, насправді наповнені неоном. Ознаки інших кольорів містять різні гази або суміші газів.
Вчені вивчали характерний рожевий колір газового розряду, створеного газом водню. Коли вузький промінь цього світла розглядався через призму, світло було розділено на чотири лінії дуже специфічних довжин хвиль (і частоти, оскільки\(\lambda\) і обернено\(\nu\) пов'язані). Спектр атомного випромінювання - це візерунок ліній, що утворюються, коли світло проходить через призму, щоб розділити його на різні частоти світла, яке він містить. На малюнку нижче показаний спектр атомного випромінювання водню.
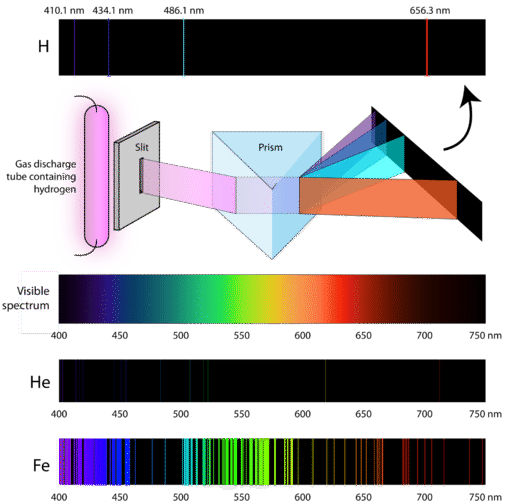
Класична теорія не змогла пояснити існування атомних емісійних спектрів, також відомих як лінійно-емісійні спектри. Згідно з класичною фізикою, атом наземного стану зможе поглинати будь-яку кількість енергії, а не лише дискретні кількості. Так само, коли атоми розслабляються назад до нижчого енергетичного стану, будь-яка кількість енергії може бути вивільнена. Це призведе до того, що відомо як безперервний спектр, де представлені всі довжини хвиль і частоти. Біле світло, що розглядається крізь призму і веселку, є прикладами суцільних спектрів. Спектри атомних випромінювань були більшим доказом квантованого характеру світла і привели до створення нової моделі атома, заснованої на квантовій теорії.
Подивіться на небо вночі, і ви побачите зірки. Звідки ми знаємо, з чого вони зроблені? Ознайомтеся з цим моделюванням, досліджуйте атомні кольори та інгредієнти, які складають наш Всесвіт.
Резюме
- Спектри атомної емісії виробляються, коли збуджені електрони повертаються в основний стан.
- Випромінюване світло електронів відповідає енергіям конкретних електронів.
Рецензія
- Що таке основний стан атома?
- Що таке збуджений стан?
- Чому ми бачимо емісійні лінії, коли електрони повертаються до стану землі?