30.3: Застосування капілярного електрофорезу
- Page ID
- 27072
Існує кілька різних форм капілярного електрофорезу, кожна з яких має свої особливі переваги. Кілька з цих способів коротко описані в цьому розділі.
Електрофорез капілярної зони (CZE)
Найпростіша форма капілярного електрофорезу - електрофорез капілярної зони. У ЧЗЕ заповнюємо капілярну трубку буфером і після завантаження зразка поміщаємо кінці капілярної трубки в резервуари, які містять додатковий буфер. Зазвичай кінець капіляра, що містить зразок, є анодом, а розчинні речовини мігрують до катода зі швидкістю, визначеною їх відповідними електрофоретичними рухливістю та електроосмотичним потоком. Спочатку виділяють катіони, з меншими, більш сильно зарядженими катіонами, що елютують перед більшими катіонами з меншими зарядами Нейтральні види елют як єдина смуга. Аніони - останній вид, який елітує, причому менші, більш негативно заряджені аніони є останніми, хто елітує.
Ми можемо змінити напрямок електроосмотичного потоку, додавши в буферний розчин алкіламмонієву сіль. Як показано на малюнку Template:index, позитивно заряджений кінець іонів алкіламонію зв'язується з негативно зарядженими іонами силанату на стінках капілярів. Хвіст іона алкіламонію гідрофобний і асоціюється з хвостом іншого алкіламонійного іона. В результаті виходить шар позитивних зарядів, які притягують аніони в буфері. Міграція цих розчинених аніонів до анода змінює напрямок електроосмотичного потоку. Порядок елюції прямо протилежний тому, що спостерігається в нормальних умовах.
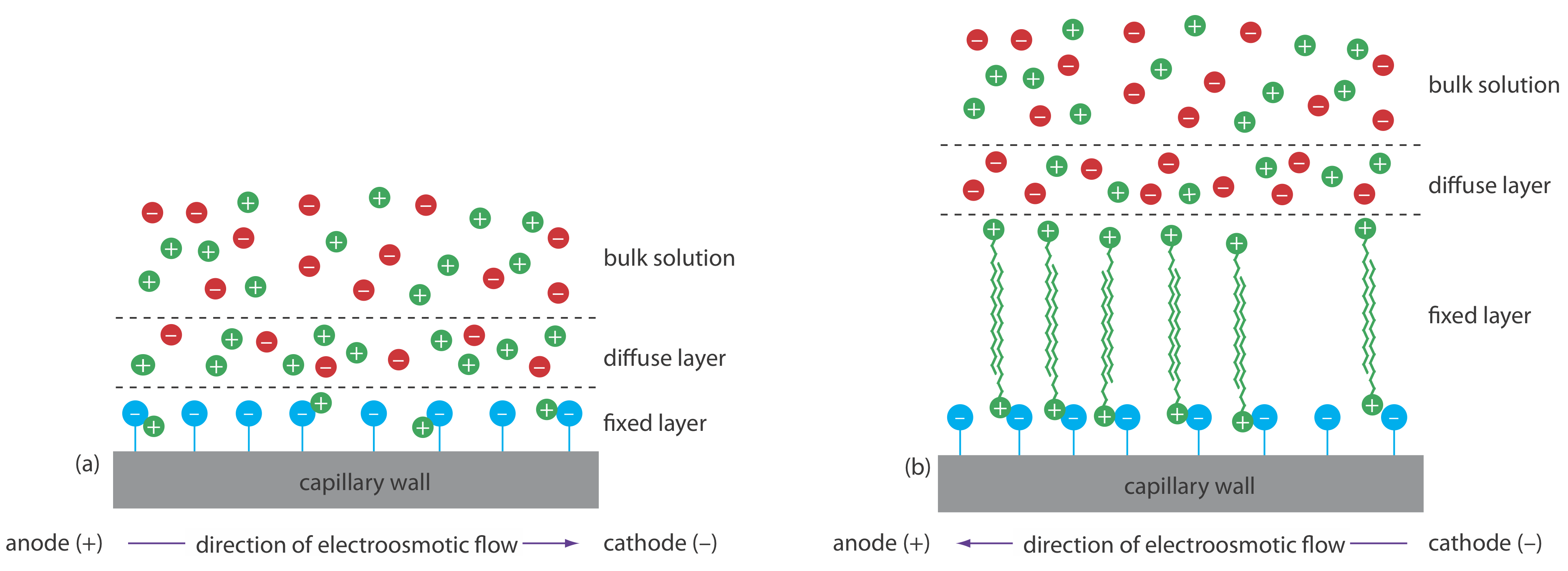
Покриття стінок капіляра неіоногенним реагентом усуває електроосмотичний потік. У такому вигляді ЦЗЕ катіони мігрують від анода до катода. Аніони елітують у вихідний резервуар, а нейтральні види залишаються нерухомими.
Електрофорез капілярної зони забезпечує ефективне відділення заряджених видів, включаючи неорганічні аніони та катіони, органічні кислоти та аміни, а також великі біомолекули, такі як білки. Наприклад, CZE використовувався для поділу суміші 36 неорганічних і органічних іонів менш ніж за три хвилини [Jones, W.R.; Jandik, P. J Chromatog. 1992, 608, 385—393]. Суміш нейтральних видів, звичайно, не може бути дозволена.
Міцелярна електрокінетична капілярна хроматографія (MEKC)
Одним з обмежень до CZE є його нездатність відокремлювати нейтральні види. Міцелярна електрокінетична капілярна хроматографія долає це обмеження, додаючи до буферного розчину поверхнево-активну речовину, таку як додецилсульфат натрію (рис. Template:index a). Додецилсульфат натрію, або SDS, складається з довголанцюгового гідрофобного хвоста і негативно зарядженої іонної функціональної групи на його голові. Коли концентрація СДС досить велика, утворюється міцелла. Міцелла складається з сферичної агломерації 40-100 молекул поверхнево-активної речовини, в якій хвости вуглеводнів спрямовані всередину, а негативно заряджені головки спрямовані назовні (рис. Template:index b).
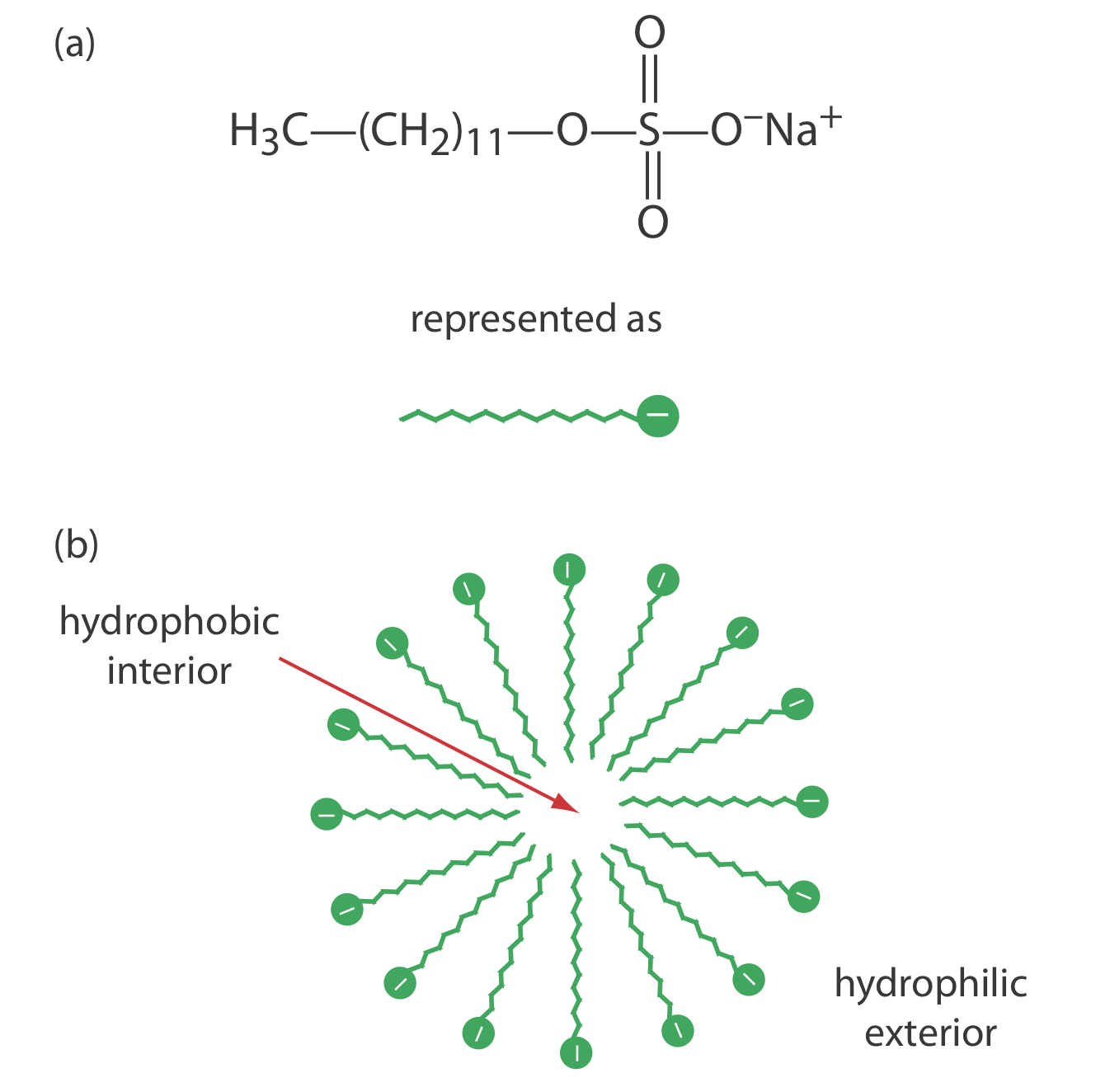
Оскільки міцели мають негативний заряд, вони мігрують до катода зі швидкістю, меншою за швидкість електроосмотичного потоку. Нейтральні види розподіляють себе між міцелами та буферним розчином таким чином, як розподіл розчинених речовин між двома рідкими фазами у ВЕРХ. Оскільки існує поділ між двома фазами, ми включаємо описовий термін хроматографія в назву техніки. Зверніть увагу, що в MEKC обидві фази рухливі.
Порядок елюції для нейтральних видів у MEKC залежить від того, наскільки кожен вид розділяється на міцели. Гідрофільні нейтрали нерозчинні у гідрофобному внутрішньому середовищі міцели і елутуються як одна смуга, як це було б у CZE. Нейтральні розчинні речовини, які надзвичайно гідрофобні, повністю розчиняються в міцеллі, елююючи міцелами як єдину смугу. Ті нейтральні види, які існують в рівновазі перегородки між буфером і міцелами, елютують між повністю гідрофільними і повністю гідрофобними нейтральними видами. Ті нейтральні види, які сприяють буферному елюту перед тими, що надають перевагу міцелам. Міцелярна електрокінетична хроматографія використовується для поділу найрізноманітніших зразків, включаючи суміші фармацевтичних сполук, вітамінів та вибухових речовин.
Капілярний гель електрофорез (CGE)
При капілярному гелевому електрофорезі капілярна трубка заповнюється полімерним гелем. Оскільки гель пористий, розчинена речовина мігрує через гель зі швидкістю, що визначається як його електрофоретичної рухливістю, так і розміром. Здатність впливати на поділ за розміром корисна, коли розчинені речовини мають подібні електрофоретичні рухливості. Наприклад, фрагменти ДНК різної довжини мають схожі співвідношення заряду до розміру, що ускладнює їх поділ за допомогою CZE. Оскільки фрагменти ДНК мають різний розмір, можливе поділ КГЕ.
Капіляр, що використовується для КГЕ, зазвичай обробляється для усунення електроосмотичного потоку, щоб запобігти екструзії гелю з капілярної трубки. Зразки вводять електрокінетично, оскільки гель забезпечує занадто великий опір для гідродинамічного відбору проб. Первинне застосування КГЕ - поділ великих біомолекул, включаючи фрагменти ДНК, білки та олігонуклеотиди.
Капілярна електрохроматографія (ЦВК)
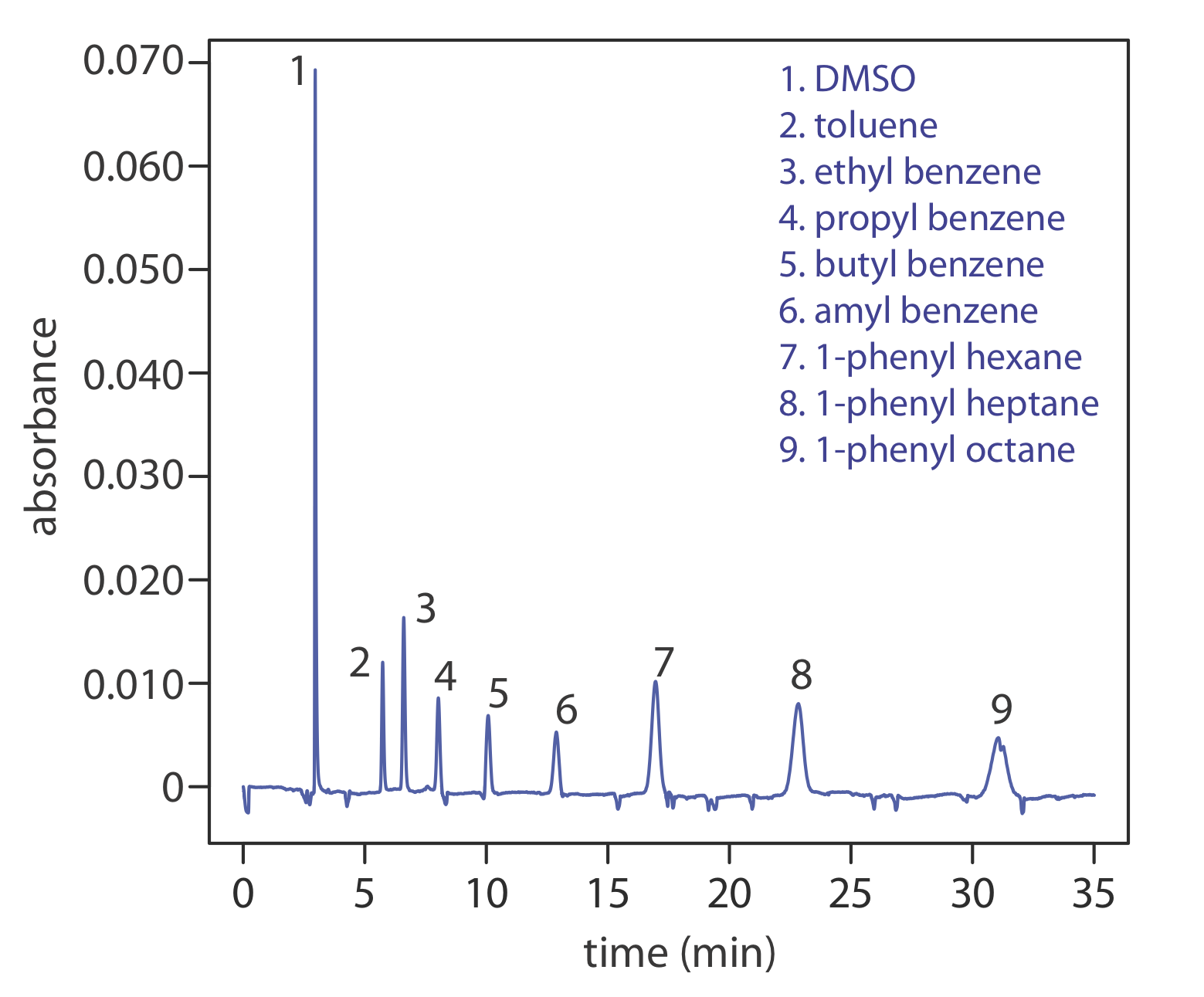
Ще одним підходом до поділу нейтральних видів є капілярна електрохроматографія. У ЦВК капілярна трубка упакована частинками 1,5-3 мкм, покритими зв'язаною стаціонарною фазою. Нейтральні види відокремлюються виходячи з їх здатності розділяти між стаціонарною фазою і буфером, який рухається в результаті електроосмотичного потоку; рис. Template:index є репрезентативним прикладом для поділу суміші вуглеводнів. Розділення CEC схоже на аналогічне поділу ВЕРХ, але без необхідності використання насосів високого тиску. Ефективність у ЦВК краща, ніж у ВЕРХ, а час аналізу коротший.