16.1: Теорія спектрометрії інфрачервоного поглинання
- Page ID
- 26951
Розуміння ІЧ-спектра
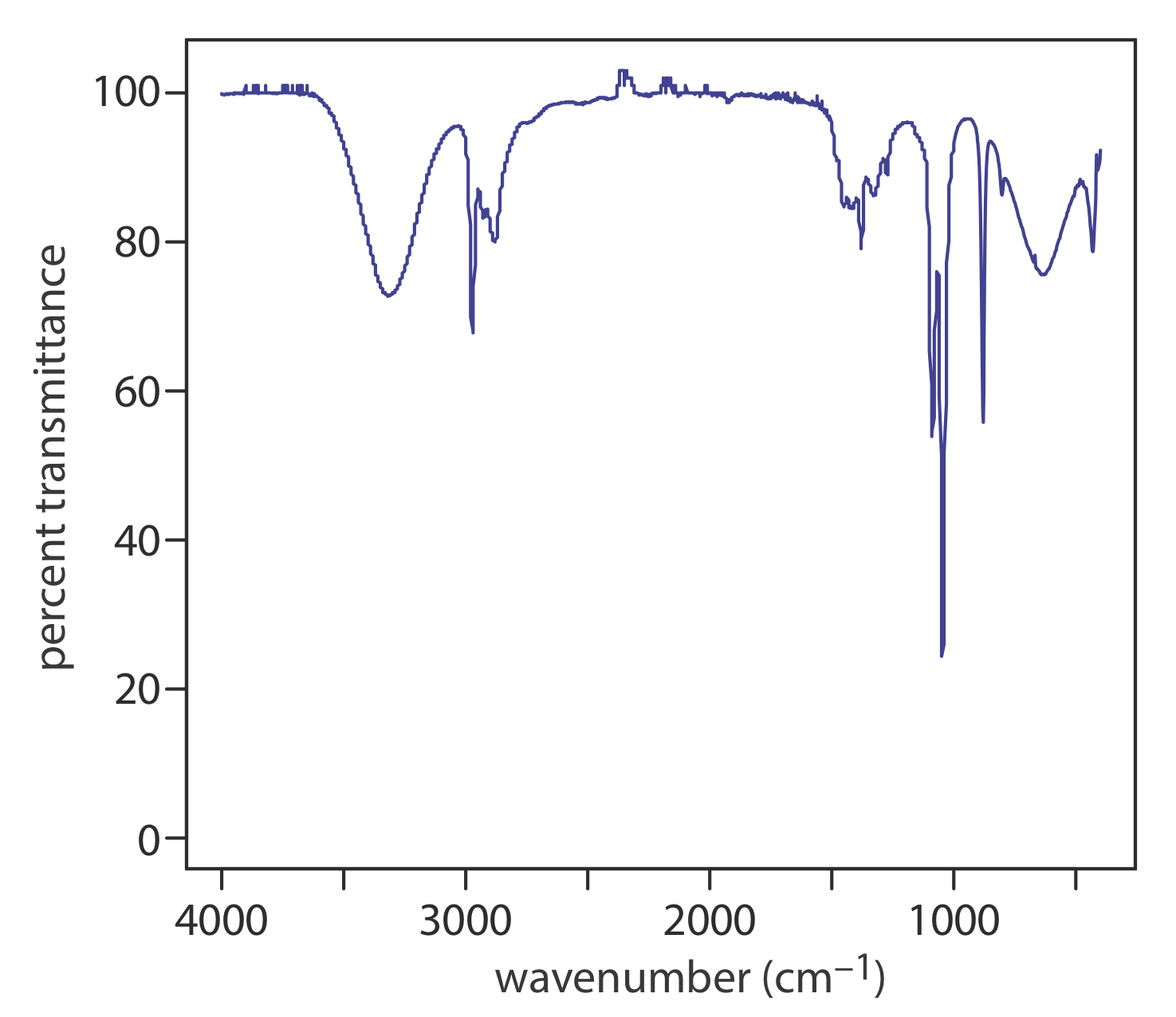
\(\PageIndex{1}\)На малюнку показаний інфрачервоний спектр для етанолу. На відміну від спектра поглинання УФ/Віс, вісь y відображається як відсоток пропускання (% T) замість поглинання, що відображає той факт, що ІК використовується більше для якісних цілей, ніж для кількісних цілей, де закон Пива, який є лінійною функцією концентрації (\(A = \epsilon b C\)) робить поглинання тим корисніше вимірювання. Вісь x для ІЧ-спектра зазвичай задається у хвильових числах\(\overline{\nu} = \lambda^{-1}\), з одиницями см —1. Піки в ІЧ-спектрі інвертовані відносно спектру поглинання; тобто вони спускаються від базової лінії 100% T замість того, щоб підніматися від базової лінії нульового поглинання.
Дипольні зміни
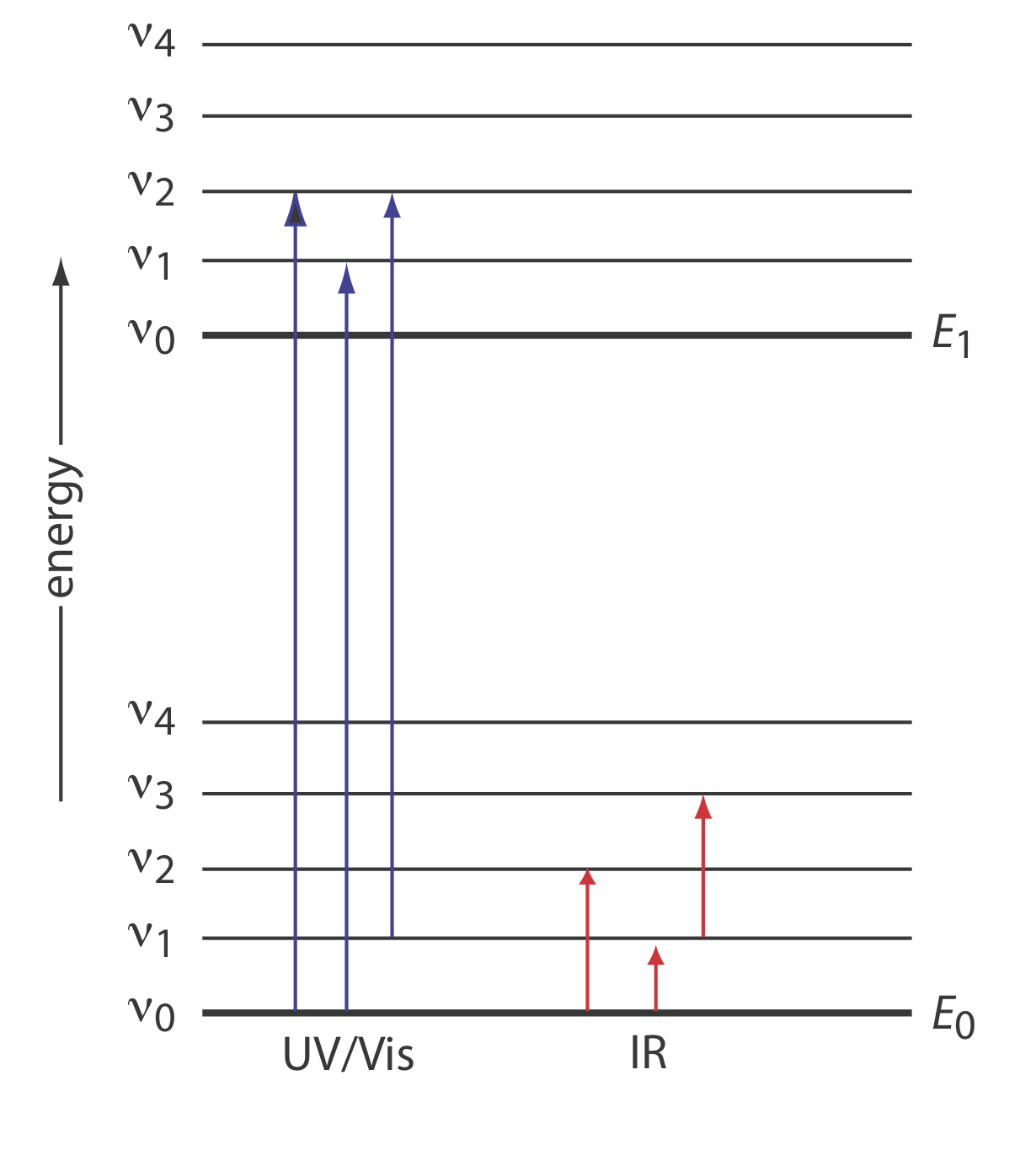
Енергії фотона інфрачервоного випромінювання (див. Рис.\(\PageIndex{2}\)) недостатньо для впливу на зміну електронних енергетичних рівнів електронів, як в атомних або молекулярних абсорбційних або емісійних спектроскопіях UV/Vis, розглянутих в главах 9, 10 і 12-15. Натомість інфрачервоне випромінювання обмежується змінами коливальних енергетичних станів молекул і молекулярних іонів. Щоб поглинути ІЧ-фотон, поглинаючий вид повинен зазнати зміни свого дипольного моменту, що дозволяє коливанню в електричному полі фотона взаємодіяти з коливанням, що відповідає в межах поглинаючого виду. Якщо два коливання мають однакову частоту, то можливе поглинання.
Кожен коливальний енергетичний стан на малюнку\(\PageIndex{2}\) також має набір обертальних енергетичних станів, що означає, що пік для певної зміни коливальних енергетичних рівнів може складатися з ряду тісно розташованих ліній, по одній на кожну з декількох змін енергії обертання. Оскільки обертання важке для аналітів, що в рідкій або твердій формах, ми зазвичай бачимо лише одну, широку лінію поглинання; з цієї причини ми розглянемо лише коливальні переходи в цьому розділі.
Типи молекулярних коливань
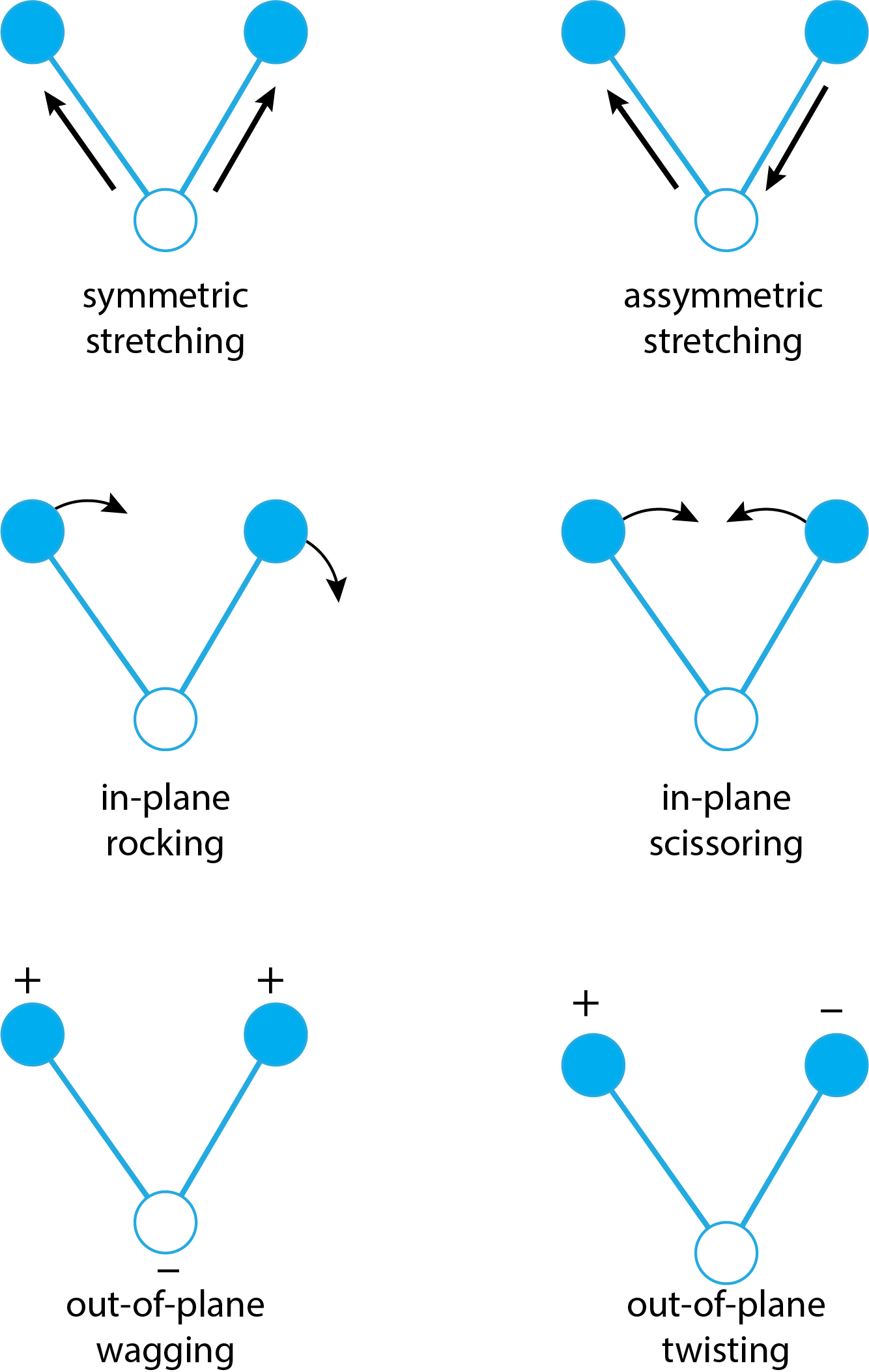
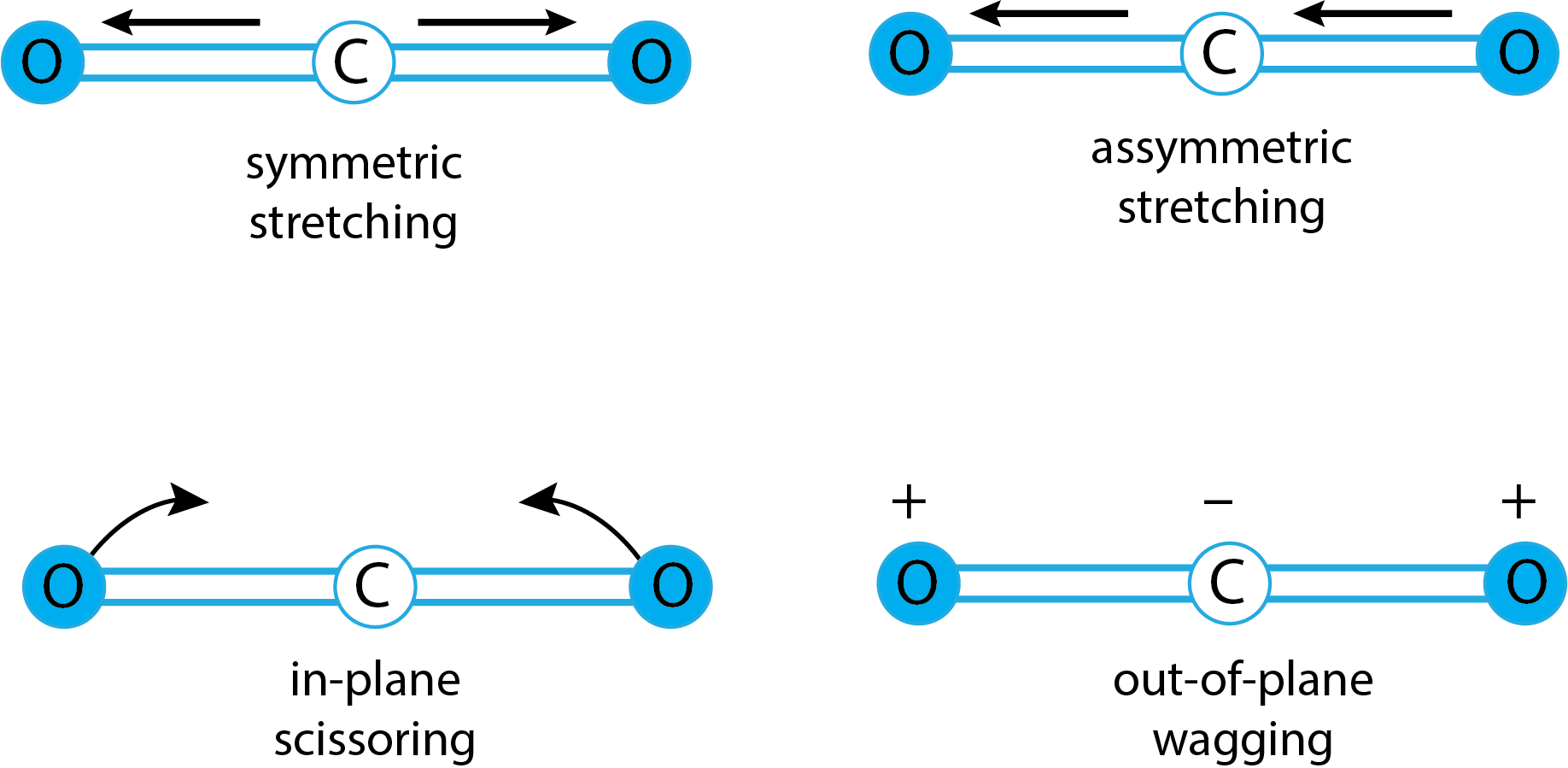
Хоча ми схильні думати про атоми в молекулі як жорстко закріплені в просторі відносно один одного, окремі атоми знаходяться в постійному стані руху: довжини зв'язків збільшуються і зменшуються при розтягуванні і стисненні, а кути зв'язку змінюються в результаті згинання зв'язків відносно кожного інші. \(\PageIndex{3}\)На малюнку показано два різних типи розтягування (симетричне та асиметричне) та чотири різних типи згинання (в площині гойдання, ножиці в площині, вилювання поза площиною та скручування поза площиною).
Навіть проста молекула може мати безліч коливальних режимів, які породжують пік в ІЧ-спектрі, як це стосується етанолу (рис.\(\PageIndex{1}\)). Число можливих нормальних коливальних мод для лінійної молекули дорівнює\(3N - 5\), де N - кількість атомів, а\(3N - 6\) для нелінійної молекули. Етанол, наприклад, має\(3 \times 9 - 6 = 21\) можливі коливальні режими. Як ми побачимо пізніше в цьому розділі, деякі з цих режимів можуть не призвести до зміни дипольного моменту, зменшуючи кількість піків в ІЧ-спектрі.
Чому нелінійна молекула має\(3N - 6\) коливальні режими? Розглянемо молекулу метану, СН 4. Кожен з п'яти атомів метану може рухатися в одному з трьох напрямків (x, y та z) загалом\(3 \times 5 = 15\) різними способами, якими атоми молекули можуть рухатися. Молекула може рухатися трьома способами: вона може переміщатися з одного місця в інше, що ми називаємо поступальним рухом; вона може обертатися навколо осі, яку ми називаємо обертальним рухом; і її зв'язки можуть розтягуватися і згинатися, що ми називаємо коливальним рухом. Оскільки вся молекула може рухатися в напрямках x, y та z, три з 15 різних способів переміщення метану є поступальними. Крім того, молекула може обертатися навколо своїх осей x, y і z, що становить три додаткові форми руху. Це залишає\(15 - 3 - 3 = 9\) коливальні режими. Лінійна молекула, така як CO 2, має\(3N - 5\) коливальні режими, оскільки вона може обертатися лише навколо двох осей.
Механічна модель розтягування в двоатомній молекулі
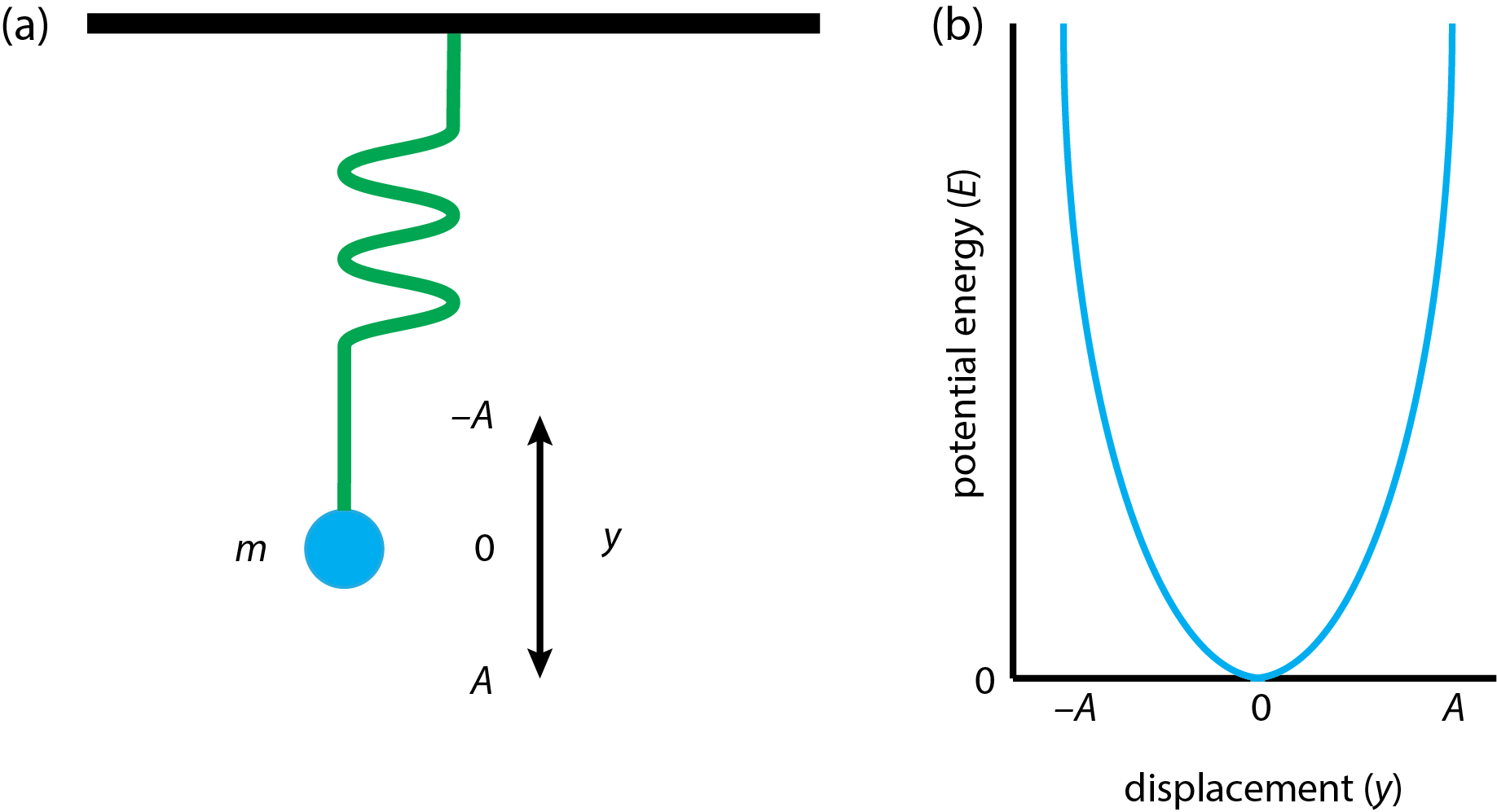
Найпростіша модель системи для розтягування і стиснення зв'язку - це вага з масою, м, прикріплений до ідеальної пружини, яка звисає зі стелі, як показано на малюнку\(\PageIndex{4}a\). Якщо ми потягнемо на масу, а потім відпустимо її, ми ініціюємо простий коливальний гармонічний рух, який ми можемо моделювати, використовуючи закон Гука. Якщо ми зміщуємо вагу на відстань, у, то сила, F, яка діє на вагу, є
\[F = - k y \label{hookeslaw} \]
\(k\)де постійна сила пружини - міра пружини пружини. Від'ємний знак в Equation\ ref {hookeslaw} вказує на те, що це сила, необхідна для відновлення пружини в початкове положення; тобто сила знаходиться в напрямку, протилежному нашому дії тяги вниз на вагу.
Потенційна енергія гармонічного осцилятора
Візьмемо потенційну енергію, Е, пружини та ваги як 0, коли вони знаходяться в стані спокою (y = 0). Якщо ми тягнемо вниз на вагу на відстань\(dy\), то зміна потенційної енергії системи\(dE\), повинна збільшуватися на добуток сили і відстані
\[dE = - F \times dy = - ky \times dy \label{PEchange} \]
Інтеграція рівняння\ ref {peChange} від\(E = 0\) до\(E = E\) і від\(y = 0\) до\(y = y\)
\[\int_0^E dE = - k \int_0^y ydy \label{PEintegrals} \]
дає енергію, як
\[E = \frac{1}{2} k y^2 \label{PE} \]
\(\PageIndex{4}b\)На малюнку показана результуюча крива потенційної енергії, для якої максимальна потенційна енергія - це\(\frac{1}{2}kA^2\) коли вага знаходиться на максимальному її зміщенні. Зверніть увагу, що крива потенційної енергії є параболою.
Частота коливань
Простий гармонічний генератор, описаний вище і показаний на малюнку,\(\PageIndex{4}\) вібрує з частотою\(\nu_0\), заданою рівнянням
\[\nu_0 = \frac{1}{2 \pi} \sqrt{\frac{k}{m}} \label{natfreq} \]
\(k\)де постійна сила пружини і\(m\) маса ваги. Ми можемо продовжити це до пружини, яка з'єднує дві ваги один з одним, замінивши масу\(m\), зменшену масу системи,\(\mu\)
\[\mu = \frac{m_1 \times m_2}{m_1 + m_2} \label{redmass} \]
де\(m_1\) і\(m_2\) є маси двох ваг. Підстановка рівняння\ ref {redmass} на рівняння\ ref {natfreq} дає
\[\nu_0 = \frac{1}{2 \pi} \sqrt{\frac{k}{\mu}} = \frac{1}{2 \pi} \sqrt{\frac{k(m_1 + m_2)}{m_1 \times m_2}} \label{natfreq2} \]
Якщо зробити припущення, що Equation\ ref {natfreq2} застосовується до простих двоатомних молекул, то ми можемо оцінити константу сили зв'язку\(k\), виміряючи її коливальну частоту.
Квантова обробка вібрацій
Рівняння\ ref {PE}\ and\ ref {natfreq2} базуються на класичній механіці обробки простого гармонічного генератора, в якому можливе будь-яке зміщення, і, таким чином, будь-яка енергія. Однак молекулярні коливання квантуються; таким чином
\[E = \left( v + \frac{1}{2} \right) \times h \times \frac{1}{2 \pi} \sqrt{\frac{k}{\mu}} = \left( v + \frac{1}{2} \right) h \nu_0 \label{quantizedE} \]
де\(v\) - коливальне квантове число, яке має допустимі значення\(0, 1, 2, \dots\). Різниця в енергії\(\Delta E\), між будь-якими двома послідовними коливальними енергетичними рівнями є\(h \nu_0\). Оскільки дозволені переходи в квантовій механіці обмежені\(\Delta \nu = \pm 1\) і оскільки різниця в енергії обмежена\(\Delta E = h \nu_0\), будь-який конкретний режим вібрації повинен породити один пік.
ангармонічна поведінка
Ідеальна поведінка, описана в останньому розділі, в якій кожен коливальний рух, який спричиняє зміну дипольного моменту, призводить до єдиного піку, не тримається через різні причини, включаючи куломбічні взаємодії між атомами, коли вони рухаються назустріч і подалі один від одного. Одним з результатів цієї неідеальної поведінки є те, що значення\(\Delta E\) не залишається постійним для всіх значень коливального квантового числа\(v\). Для більших значень\(v\), значення\(\Delta E\) стає меншим і переходи, де\(\Delta v = \pm 2\) або\(\Delta v = \pm 3\) стають можливими, породжуючи те, що називаються обертоновими лініями на частотах, які є\(2 \times\) або\(3 \times\) що для\(\nu_0\).
Чому ми бачимо більше або менше вібраційних піків, ніж очікувалося?
\(\PageIndex{5}\)На малюнку показаний ІЧ-спектр для вуглекислого газу СО 2, який складається з трьох скупчень піків, розташованих приблизно в 670 см —1, 2350 см —1, і 3700 см —1. Оскільки вуглекислий газ є лінійною молекулою, яка складається з двох подвійних зв'язків вуглець-кисень (O = C = O), він має\(3 \times 3 - 5 = 9 - 5 = 4\) коливальні режими. Так чому ж ми бачимо лише три скупчення піків?
Однією з вимог до поглинання інфрачервоного випромінювання є те, що коливальний рух повинен призвести до зміни дипольного моменту. \(\PageIndex{6}\)На малюнку показані чотири коливальні режими для СО 2. З цих чотирьох коливальних режимів симетричне розтягнення не призводить до зміни дипольного моменту. Хоча це, здається, пояснює, чому ми бачимо лише три скупчення піків, уважне вивчення двох згинальних рухів на малюнку\(\PageIndex{6}\) повинно переконати вас, що вони ідентичні і, отже, з'являться як єдиний пік.
Так що ж є джерелом скупчення піків близько 3700 см —1? Іноді поглинання одного фотона збуджує два і більше коливальних режимів. При цьому хвильове число для цієї смуги поглинання еквівалентно сумі хвильових чисел для асиметричного розтягування і двох вироджених режимів вигину (2349+ 667 = 3016 см —1, і 2349 + 667 + 667 = 3683 см —1). Вони називаються комбінованими смугами.
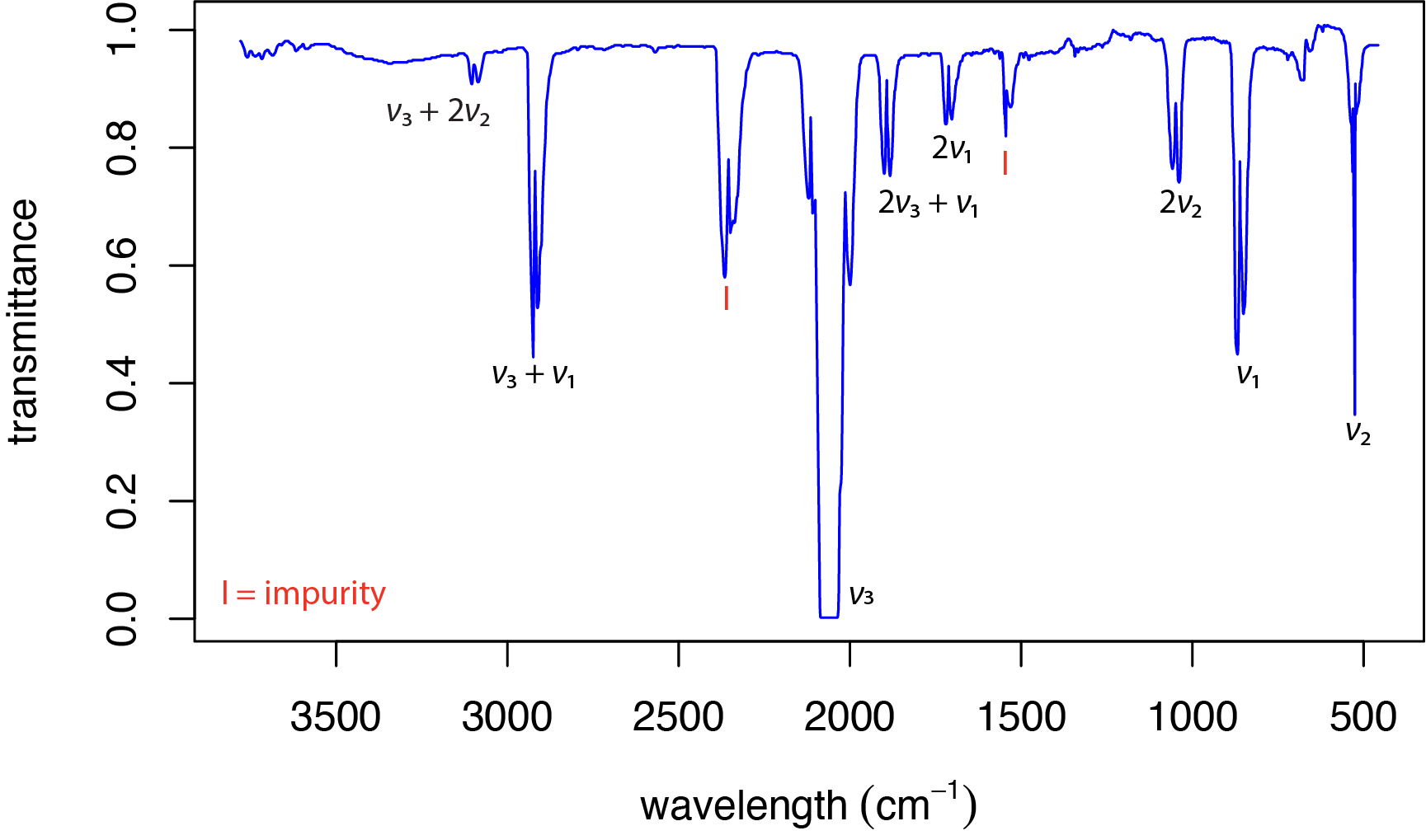
Ще одним джерелом додаткових піків є обертонні смуги, в яких\(\Delta v = \pm 2\) або\(\Delta v = \pm 3\). \(\PageIndex{7}\)На малюнку показаний ІЧ-спектр для карбонілсульфіду, OCS, який є аналогом СО 2, в якому один з киснів замінений сіркою. Пік в 520 см —1 призначений для двох його вироджених згинальних рухів і маркується\(\nu_2\). Асиметрична розтяжка на рівні 2062 см —1\((\nu_3)\) і симетрична розтяжка на 859 см —1\((\nu_1)\) є іншими двома основними смугами поглинання. Решта піків є обертонами, такими як пік з\(2 \nu_2\) позначкою 1040 см —1, або комбіновані смуги, такі як пік з\(\nu_3 + \nu_1\) позначкою 2921 см —1. Багато з піків виглядають як два піки; це є результатом зміни обертальної енергії, а також.