2,4: Силікатні мінерали
- Page ID
- 36167
Переважна більшість мінералів, що входять до складу гірських порід земної кори, є силікатними мінералами. До них відносяться такі мінерали, як кварц, польовий шпат, слюда, амфіболи, піроксен, олівін та різноманітні глинисті мінерали. Будівельним блоком всіх цих мінералів є тетраедр кремнію, комбінація чотирьох атомів кисню і одного атома кремнію. Як ми бачили, це називається тетраедр, тому що площини, проведені через атоми кисню, утворюють форму з 4 поверхнями (рис.\(\PageIndex{4}\)). Оскільки іон кремнію має заряд 4, а кожен з чотирьох іонів кисню має заряд −2, тетраедр кремнію має чистий заряд −4.
У силікатних мінералах ці тетраедри розташовані і пов'язані між собою різними способами, від одиничних одиниць до складних каркасів (табл. 2.6). Найпростіша силікатна структура, що складається з мінерального олівіну, складається з ізольованих тетраедр, пов'язаних з іонами заліза та/або магнію. В олівіні заряд −4 кожного тетраедра кремнезему врівноважений двома двовалентними (тобто +2) катіонами заліза або магнію. Олівін може бути або Mg 2 SiO 4 або Fe 2 SiO 4, або деякою комбінацією двох (Mg, Fe) 2 SiO 4. Двовалентні катіони магнію і заліза досить близькі за радіусом (0,73 проти 0,62 ангстрем [1]). Через таку схожість розмірів, а також через те, що вони обидва двовалентні катіони (обидва можуть мати заряд +2), залізо і магній можуть легко замінювати один одного в олівіні та багатьох інших мінералах.
| Зображення конфігурації тетраедра | Назва конфігурації тетраедра | Приклад мінералів |
|---|---|---|
 |
Ізольовані (незосилікати) | Олівін, гранат, циркон, кіаніт |
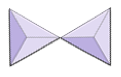 |
Пари (соросилікати) | Епідот, цоізит |
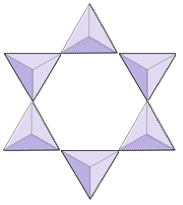 |
Кільця (циклосилікати) | Турмалін |
 |
Одинарні ланцюги (іносилікати) | Піроксени, волластоніт |
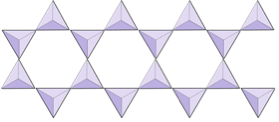 |
Подвійні ланцюги (іносилікати) | Амфіболи |
 |
Листи (філлосилікати) | Слюда, глинисті мінерали, серпантин, хлорит |
| 3-вимірна структура | Фреймворк (тектосилікати) | Польові шпати, кварц, цеоліт |

Виріжте навколо зовнішньої частини фігури (суцільні лінії і пунктирні лінії), а потім складіть уздовж суцільних ліній, щоб утворився тетраедр. Якщо у вас є клей або скотч, закріпіть вкладки на тетраедр, щоб скріпити його разом. Якщо у вас немає клею або скотча, зробіть зріз уздовж тонкої сірої лінії і вставте загострений язичок в щілину.
Якщо ви робите це в класі, спробуйте з'єднати свій тетраедр з іншими в пари, кільця, одинарні та подвійні ланцюги, листи і навіть тривимірні рамки.
Див Додаток 3 для вправ 2.3 відповіді.
В олівіні, на відміну від більшості інших силікатних мінералів, тетраедри кремнезему не пов'язані між собою. Замість цього вони пов'язані з іонами заліза та/або магнію, в конфігурації, наведеній на малюнку\(\PageIndex{1}\).

Як уже зазначалося, 2 іона заліза і магнію схожі за розмірами (хоча і не зовсім однакові). Це дозволяє їм замінювати один одного деякими силікатними мінералами. Насправді іони, які поширені в силікатних мінералах, мають широкий діапазон розмірів, як зображено на малюнку\(\PageIndex{2}\). Всі показані іони є катіонами, крім кисню. Зверніть увагу, що залізо може існувати як іон +2 (якщо він втрачає два електрони під час іонізації), так і іон +3 (якщо він втрачає три). Fe 2+ відомий як чорне залізо. Fe 3+ відомий як залізо. Іонні радіуси мають вирішальне значення для складу силікатних мінералів, тому ми знову звернемося до цієї діаграми.

Будова одноланцюгового силікатного піроксена показано на малюнках 2.4.3 і 2.4.4. У піроксені тетраедри кремнезему пов'язані між собою в єдиний ланцюг, де один іон кисню з кожного тетраедра ділиться з сусіднім тетраедром, отже, в структурі менше кисню. Результатом є те, що співвідношення кисню до кремнію нижче, ніж у олівіну (3:1 замість 4:1), а чистий заряд на атом кремнію менше (−2 замість −4). Тому для збалансування цього заряду потрібно менше катіонів. Піроксенові композиції мають тип MgSiO 3, FeSiO 3 і CasiO 3, або деяку їх комбінацію. Піроксен також може бути записаний як (Mg, Fe, Ca) SiO 3, де елементи в дужках можуть бути присутніми в будь-якій пропорції. Іншими словами, піроксен має один катіон для кожного тетраедра кремнезему (наприклад, MgSiO 3), тоді як олівін має два (наприклад, Mg 2 SiO 4). Оскільки кожен іон кремнію дорівнює +4, а кожен іон кисню −2, три кисню (−6) та один кремній (+4) дають чистий заряд −2 для одного ланцюга тетраедри кремнезему. У піроксені один двовалентний катіон (2) на тетраедр врівноважує цей заряд −2. В олівіні потрібно два двовалентні катіони, щоб збалансувати заряд −4 ізольованого тетраедрону. Структура піроксену є більш «дозволентною», ніж олівін—це означає, що в неї можуть вписатися катіони з більш широким діапазоном іонних радіусів. Ось чому піроксени можуть мати катіони заліза (радіус 0,63 Å) або магнію (радіус 0,72 Å) або кальцію (радіус 1,00 Å) (див. Рисунок\(\PageIndex{2}\) вище).


На схемі нижче представлена єдина ланцюг в силікатному мінералі. Підрахуйте кількість тетраедр проти кількості іонів кисню (жовті сфери). Кожен тетраедр має один іон кремнію, тому це повинно дати вам співвідношення Si до O в одноланцюгових силікатах (наприклад, піроксену).

На схемі нижче представлена подвійна ланцюг в силікатному мінералі. Знову порахуйте кількість тетраедр проти кількості іонів кисню. Це повинно дати вам співвідношення Si до O у дволанцюгових силікатах (наприклад, амфіболах).

Див Додаток 3 для вправ 2.4 відповіді.
У амфіболних структурах тетраедри кремнезему пов'язані подвійним ланцюгом, який має відношення кисню до кремнію нижче, ніж у піроксену, і, отже, все ще менше катіонів необхідно для збалансування заряду. Амфібола ще більш дозвільна, ніж піроксена і його склади можуть бути дуже складними. Наприклад, рогобленда може включати натрій, калій, кальцій, магній, залізо, алюміній, кремній, кисень, фтор та іон гідроксилу (ОН −).
У слюдяних структурах тетраедри кремнезему розташовані в суцільних аркушах, де кожен тетраедр розділяє три аніони кисню з сусідніми тетраедрами. Існує ще більше спільного використання кисню між сусідніми тетраедрами, і, отже, для збалансування заряду структури кремнія-тетраедри в листових силікатних мінералах потрібно менше катіонів. Склеювання між листами відносно слабке, і на це припадає добре розвинене однонаправлене розщеплення у слюд (рис.\(\PageIndex{5}\)). Біотитова слюда може містити залізо та/або магній, що робить її феромагнезіальним силікатним мінералом (наприклад, олівіном, піроксеном та амфіболом). Хлорит - ще один подібний мінерал, який зазвичай включає магній. У слюди мусковита єдиними катіонами є алюміній і калій; отже, це неферомагнезіальний силікатний мінерал.

Окрім мусковіту, біотиту та хлориту, існує багато інших листових силікатів (вони ж філлосилікати), багато з яких існують у вигляді фрагментів розміром з глину (тобто менше 0,004 міліметрів). До них відносяться глинисті мінерали каолініт, іліт та смектит, і хоча вони важко вивчаються через їх дуже малі розміри, вони є надзвичайно важливими компонентами гірських порід і особливо грунтів.
Всі листові силікатні мінерали також мають молекули води в своїй структурі.
Кварцеві тетраедри скріплюються в тривимірних рамках як в польових шпатах, так і в кварці. Це неферомагнезіанние мінерали - вони не містять ні заліза, ні магнію. Крім тетраедри кремнезему польові шпати включають катіони алюмінію, калію, натрію та кальцію в різних комбінаціях. Кварц містить тільки тетраедра кремнезему.
Три основні мінерали польового шпату - калієвий польовий шпат (він же K-польовий шпат або К-шпат) та два типи плагіоклазу польового шпату: альбіт (лише натрій) та анортит (лише кальцій). Як і у випадку з залізом та магнієм в олівіні, існує безперервний діапазон композицій (серія твердих розчинів) між альбітом та анортитом у плагіоклазі. Оскільки іони кальцію і натрію майже однакові за розміром (1,00 Å проти 0,99 Å) будь-які проміжні композиції між CaAl 2 Si 3 O 8 і NaAlSi 3 O 8 можуть існувати (рис.\(\PageIndex{6}\)). Це трохи дивно, оскільки, хоча вони дуже схожі за розміром, іони кальцію та натрію не мають однакового заряду (Ca 2+ проти Na +). Ця задача пояснюється відповідною заміною Al +3 на Si +4. Тому альбіт - це NaAlSi 3 O 8 (1 Al і 3 Si), тоді як анортит - CaAl 2 Si 2 O 8 (2 Al і 2 Si), а польові шпати плагіоклази проміжного складу мають проміжні пропорції Al і Si. Це називається «парна заміна».
Польові шпати з проміжним складом плагіоклази - олігоклаза (від 10% до 30% Са), андезин (від 30% до 50% Са), лабрадорит (від 50% до 70% Са) та бітуніт (від 70% до 90% Са). K-польовий шпат (KalSi 3 O 8) має дещо іншу структуру, ніж у плагіоклази, через більший розмір іона калію (1,37 Å) і через цей великий розмір калій і натрій не легко замінюють один одного, за винятком високих температур. Ці високотемпературні польові шпати, ймовірно, можна знайти лише у вулканічних породах, оскільки нав'язливі магматичні породи досить повільно охолоджуються до низьких температур, щоб польові шпати перетворилися на одну з форм нижчої температури.

У кварці (SiO 2) тетраедри кремнезему пов'язані в «ідеальному» тривимірному каркасі. Кожен тетраедр пов'язаний з чотирма іншими тетраедрами (з киснем, розділеним на кожному куті кожного тетраедра), і в результаті співвідношення кремнію до кисню становить 1:2. Оскільки один катіон кремнію має заряд +4, а два аніони кисню мають заряд −2, заряд збалансований. Немає необхідності в алюмінії або будь-яких інших катіонів, таких як натрій або калій. Твердість і відсутність розщеплення в кварці виникають внаслідок сильних ковалентних/іонних зв'язків, характерних для тетраедра кремнезему.
Силікатні мінерали класифікуються як феромагнезіанние або неферомагнезіанние залежно від того, чи є вони залізо (Fe) та/або магній (Mg) у своїй формулі. Ряд мінералів і їх формули наведені нижче. Для кожного вкажіть, чи це феромагнезіальний силікат.
| Мінеральні | Формула | Феромагнезіальний силікат? |
| олівін | (Мг, Фе) 2 SiO 4 | . |
| пірит | ФеС 2 | . |
| плагіоклаз польовий шпат | Акаль 2 Сі 2 О 8 | . |
| піроксену | MgSiO 3 | . |
| гематит | Фр 2 З 3 | . |
| ортоклаз польовий шпат | КАЛСі 3 О 8 | . |
| кварц | ІСО 2 | . |
| амфібола | Фе 7 Сі 8 О 22 (ОН) 2 | . |
| москвич | К 2 Ал 4 Сі 6 Ал 2 Про 20 (ОН) 4 | . |
| магнетит | Фр 3 З 4 | . |
| біотит | К 2 фр 4 Ал 2 Сі 6 Ал 4 О 20 (ОН) 4 | . |
| доломіту | (Са, Мг) СО 3 | . |
| гранат | Лт 2 Ал 2 Сі 3 О 12 | . |
| серпантин | Мг 3 Сі 2 О 5 (ОН) 4 | . |
Див Додаток 3 для вправ 2.5 відповіді. *Деякі формули, особливо більш складні, були спрощені.
Описи зображень
| Елемент | Іонні радіуси (в ангстремах) | Заряджати |
|---|---|---|
| Кисень | 1.4 | −2 (Аніон) |
| Калій | 1.37 | 1 (Катіон) |
| Кальцій | 1.00 | 2 (Катіон) |
| Натрій | 0,99 | 1 (Катіон) |
| Магній | 0,72 | 2 (Катіон) |
| Залізо | 0,63 | 2 (Катіон) |
| 0,49 | 3 (Катіон) | |
| Алюміній | 0,39 | 3 (Катіон) |
| Кремній | 0,26 | 4 (Катіон) |
| Вуглець | 0,15 | 4 (Катіон) |
[Повернутися до малюнка\(\PageIndex{2}\)]
- Ангстрем - це одиниця, яка зазвичай використовується для вираження розмірів атомної шкали. Один ангстрем становить 10 −10 метрів або 0.0000000001 метрів. Символ ангстрема - Å. م
