2.2: Склеювання та решітки
- Page ID
- 36115
Як ми щойно бачили, атом прагне мати повну зовнішню оболонку (тобто вісім електронів для більшості елементів або два електрони для водню та гелію), щоб бути атомно стабільною. Це досягається шляхом передачі або обміну електронами з іншими атомами. Home

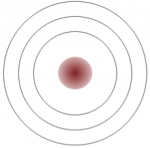
Натрій має 11 електронів: два в першій оболонці, вісім в другій і один в третій (рис.\(\PageIndex{1}\)). Натрій легко віддає цей єдиний електрон третьої оболонки, і коли він втрачає цей негативний заряд, він стає позитивно зарядженим (тому що зараз він має 11 протонів і лише 10 електронів). Відмовляючись від свого самотнього електрона третьої оболонки, натрій закінчується повною зовнішньою оболонкою. Хлор, з іншого боку, має 17 електронів: два в першій оболонці, вісім у другій і сім в третій. Хлор охоче приймає восьмий електрон, щоб заповнити свою третю оболонку, і тому стає негативно зарядженим, оскільки має 17 протонів і 18 електронів. Змінюючи свою кількість електронів, ці атоми стають іонами - натрій втрачає електрон, щоб стати позитивним іоном або катіоном, а хлор отримує електрон, щоб стати негативним іоном або аніоном (рис.\(\PageIndex{1}\)).
Оскільки негативні і позитивні заряди притягуються, іони натрію і хлору можуть склеюватися, створюючи іонний зв'язок. Електрони можна вважати, що передаються від одного атома до іншого в іонному зв'язку. Звичайна кухонна сіль (NaCl) - мінерал, що складається з хлору і натрію, з'єднаних між собою іонними зв'язками (рис.\(\PageIndex{1}\)). Назва мінералу NaCl - галіт.
Такий елемент, як хлор, також може утворювати зв'язки, не утворюючи іонів. Наприклад, два атоми хлору, кожен з яких шукає восьмий електрон у своїй зовнішній оболонці, можуть ділитися електроном у тому, що відомо як ковалентний зв'язок, утворюючи хлорний газ (Cl 2) (рис.\(\PageIndex{2}\)). Електрони діляться в ковалентної зв'язку.

Ряд елементів перераховані нижче разом з їх атомними номерами. Припускаючи, що перша електронна оболонка може містити два електрони, а наступні електронні оболонки можуть утримувати вісім електронів, намалюйте в електронних конфігураціях цих елементів. Передбачте, чи може елемент утворювати катіон (+) або аніон (−), коли відбувається перенесення електронів, і який заряд він матиме (наприклад, +1, +2, −1).
Перший з них зроблений за вас. Фтору потрібен додатковий електрон, щоб мати 8 у зовнішній оболонці, і при отриманні цього електрона він став негативно зарядженим.
Див Додаток 3 для вправ 2.1 відповіді.
| Фтор (9)
аніон (−1) | Літій (3) ________ |
| Магній (12) ________ | Аргон (18) ________ |
| Хлор (17) ________ | Берилій (3) ________ |
| Кисень (8) ________ | Натрій (11) ________ |
Атом вуглецю має шість протонів і шість електронів; два електрони знаходяться у внутрішній оболонці і чотири - у зовнішній оболонці (рис.\(\PageIndex{3}\)). Carbon would need to gain or lose four electrons to have a filled outer shell, and this would create too great a charge imbalance for the ion to be stable. On the other hand, carbon can share electrons to create covalent bonds. In the mineral diamond, the carbon atoms are linked together in a three-dimensional framework, where each carbon atom is bonded to four other carbon atoms and every bond is a very strong covalent bond. In the mineral graphite, the carbon atoms are linked together in sheets or layers (Figure \(\PageIndex{3}\)), and each carbon atom is covalently bonded to three others. Graphite-based compounds, which are strong because of the strong intra-layer covalent bonding, are used in high-end sports equipment such as ultralight racing bicycles. Graphite itself is soft because the bonding between these layers is relatively weak, and it is used in a variety of applications, including lubricants and pencils.

Кремній і кисень зв'язуються разом, щоб створити тетраедр кремнію, який являє собою чотиригранну форму піраміди з O на кожному куті і Si посередині (рис.\(\PageIndex{4}\)). Ця структура є будівельним блоком з силікатних мінералів (які описані в розділі 2.4). Зв'язки в тетраедрі кремнезему мають деякі властивості ковалентних зв'язків і деякі властивості іонних зв'язків. В результаті іонного характеру кремній стає катіоном (з зарядом +4) і кисень стає аніоном (з зарядом -2). Чистий заряд тетраедра кремнезему (SiO 4) становить: 4 + 4 (−2) = 4 − 8 = −4. Як ми побачимо пізніше, тетраедри кремнезему (множина тетраедра) зв'язуються між собою різними способами, утворюючи більшість поширених мінералів кори.

Більшість мінералів характеризуються іонними зв'язками, ковалентними зв'язками або комбінацією цих двох, але є й інші типи зв'язків, які важливі в мінералах, включаючи металеві зв'язки та слабші електростатичні сили (водневі або вандер-Ваальсові зв'язки). Металеві елементи мають зовнішні електрони, які відносно нещільно утримуються. (Метали виділені в таблиці Менделєєва в Додатку 1.) Коли між такими атомами утворюються зв'язки, ці електрони можуть вільно переміщатися від одного атома до іншого. Таким чином, метал можна розглядати як масив позитивно заряджених атомних ядер, занурених у море рухливих електронів. Ця особливість пояснює два дуже важливих властивості металів: їх електропровідність і їх податливість (вони можуть деформуватися і формуватися).
Молекули, які пов'язані іонічно або ковалентно, також можуть мати інші слабші електростатичні сили, що утримують їх разом. Прикладами цього є сила, що утримує графітові листи разом, і тяжіння між молекулами води.
Що з усіма цими іменами «sili»?
Елемент кремній є одним з найважливіших геологічних елементів і є другим за поширеністю елементом в земній корі (після кисню). Кремній легко зв'язується з киснем, утворюючи тетраедр кремнію (рис.\(\PageIndex{4}\)). Чисті кристали кремнію (створені в лабораторії) використовуються для виготовлення напівпровідникових носіїв для електронних пристроїв. Силікатний мінерал - це той, в якому кремній і кисень присутні у вигляді тетраедри кремнію. Діоксид кремнію також відноситься до хімічного компонента гірської породи і виражається в% SiO 2. Мінеральний кварц повністю складається з тетраедри кремнезему, а деякі форми кварцу також відомі як «кремнезем». Силікон - це синтетичний продукт (наприклад, силіконовий каучук, смола або конопатка), виготовлений з кремнієво-кисневих ланцюгів та різних органічних молекул. Щоб допомогти вам зберегти імена «sili» прямо, ось зведена таблиця:
| Назва «Сілі» | Визначення |
|---|---|
| кремнію | 14-й елемент |
| кремнієві пластини | Кристал чистого кремнію, нарізаний дуже тонко і використовується для електроніки |
| Кварцовий тетраедр | Поєднання одного атома кремнію і чотирьох атомів кисню, які утворюють тетраедр |
| % кремнезю | Частка породи, яка складається з компонента SiO 2 |
| кремнезем | Тверда речовина, виготовлена з SiO 2 (але не обов'язково мінералу - наприклад, опал) |
| Силікатна | Мінерал, який містить тетраедра кремнезему (наприклад, кварц, польовий шпат, слюда, олівін) |
| Силіконові | Гнучкий синтетичний матеріал, що складається з ланцюгів Si—O з приєднаними органічними молекулами |
Елементи, які мають повну зовнішню оболонку, описуються як інертні, оскільки вони не мають тенденцію реагувати з іншими елементами, утворюючи сполуки. Це тому, що їм не потрібно втрачати або отримувати будь-які електрони, щоб стати стабільними, і тому вони не стають іонами. Всі вони відображаються в крайній правій колонці таблиці Менделєєва. Прикладами є: гелій, неон, аргон і т.д.
Як описано в розділі 1, всі мінерали характеризуються специфічним тривимірним малюнком, відомим як решітка або кристалічна структура. Ці структури варіюються від простого кубічного малюнка галіту (NaCl) (рис.\(\PageIndex{1}\)), до дуже складних візерунків деяких силікатних мінералів. Два мінерали можуть мати однаковий склад, але дуже різні кристалічні структури і властивості. Наприклад, графіт і алмаз складаються лише з вуглецю, але хоча алмаз є найтвердішою речовиною з відомих, графіт м'якший, ніж папір. Їх гратчасті структури порівнюються на рис\(\PageIndex{5}\).

Мінеральні решітки мають важливі наслідки для мінеральних властивостей, на прикладі твердості алмазу і м'якості графіту. Грати також визначають форму, в якій ростуть мінеральні кристали і як вони ламаються. Наприклад, прямі кути в решітці мінералу галіт (рис.\(\PageIndex{1}\)) впливають як на форму його кристалів (кубічних), так і на спосіб розбивання цих кристалів (рис.\(\PageIndex{6}\)).

Описи зображень
Опис\(\PageIndex{1}\) зображення на малюнку: Натрій має один електрон у зовнішній оболонці, а хлор має 7 електронів у своїй зовнішній оболонці. Один зовнішній електрон натрію переходить до хлору, що робить хлор трохи негативним, а натрій трохи позитивним. Вони притягують один одного і разом утворюють хлорид натрію. [Повернутися до малюнка\(\PageIndex{1}\)]
Опис\(\PageIndex{3}\) зображення на малюнку: (Зліва) Атом вуглецю має два електрони у внутрішній оболонці і чотири електрони у зовнішній оболонці. (Праворуч) Один атом вуглецю поділяє електрони з чотирма іншими атомами вуглецю, утворюючи повну зовнішню оболонку. [Повернутися до малюнка\(\PageIndex{3}\)]
Атрибуції ЗМІ
- Малюнки 2.2.1, 2.2.2, 2.2.3, 2.2.4, 2.2.5 та 2.2.6 (праворуч): © Стівен Ерл. КУБ.СМ ПО.
- Малюнок\(\PageIndex{6}\) (ліворуч): Галіт. © Роб Лавінський, iRocks.com. КУБ.СМ ПО-СА.