4.1: Бінарні системи
- Page ID
- 29110
Поки що ми зосередили свою увагу на однокомпонентних системах (також званих унарними, однокомпонентними або чистокомпонентними системами). Однак реальні системи ніколи не є однокомпонентними; це багатокомпонентні системи. Найпростіша з цієї категорії - двійкова система. Хороша новина, однак, полягає в тому, що поведінка багатокомпонентних систем досить схожа на поведінку бінарних систем. Тому зупинимося на бінарних системах, так як їх простіше проілюструвати.
Помістимо два гази (А і В) в ізотермічну комірку. Як ми робили раніше, ми будемо підтримувати постійну температуру під час цього експерименту (показано на рис.4.1.1)
Якщо ми рухаємо поршень вниз, ми стискаємо гази, викликаючи зменшення обсягу. При такому розкладі відбудеться підвищення тиску. Процес починається в точці А, як показано на малюнку 4.1.2, умова повного пара.
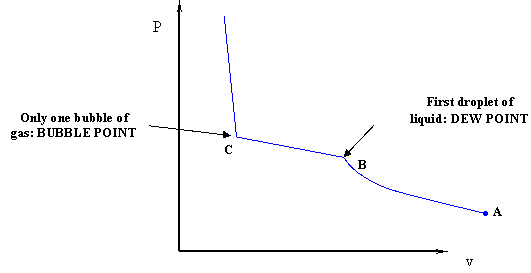
Нічого тут не є новим щодо стиснення самої пари. Зі збільшенням тиску відповідно зменшується обсяг. Після деякого стиснення з'явиться перша крапелька рідини. Тобто ми знайшли точку роси суміші (точка В). Потім приступаємо до стиснення. У міру подальшого стиснення системи буде з'являтися більше рідини і обсяг буде продовжувати зменшуватися.
Здавалося б, ми бачимо тут ті ж особливості, що і у однокомпонентної системи, яку ми вивчали в попередніх модулів. Але почекайте хвилинку, це так?
Власне, різниця є. Під час фазового переходу тиск не залишається постійним в цьому експерименті. Насправді, коли стиснення прогресує і утворюється більше рідини, тиск продовжує зростати - хоча і не так різко, як в однофазній парній області. Коли вся система стала рідкою, залишилася лише нескінченно мала бульбашка пари, ми знаходимося в точці С - точці бульбашки суміші. Зверніть увагу, що для бінарних сумішей (як у випадку з багатокомпонентними сумішами) точка роси і точка бульбашки не виникають при однаковому тиску для ізотермічного стиснення. Якщо згадати, для однокомпонентної системи точка роси і точка бульбашки збігаються. Це не вірно для двійкових і багатокомпонентних систем. Порівняйте малюнок 4.1.2 з малюнком 3.2.4 (повторюється нижче з модуля 3), щоб побачити цю точку.

ЧОМУ?? Чому підвищується тиск під час фазового переходу? У цей момент ми починаємо усвідомлювати способи, якими склад відіграє фундаментальну роль у поведінці сумішей.
В однокомпонентної системі і рідина, і пара в двофазної області мають однаковий склад (всередині системи є тільки одне хімічна речовина). Зараз, коли суміш існує в двофазному стані, присутні різні молекули різних видів і вони можуть перебувати як в рідкому, так і пароподібному стані (двофазний стан). Деякі з них «воліють» перебувати в газовій фазі, а інші «воліють» перебувати в рідкій фазі. Це «перевагу» контролюється волатильністю даного компонента. Коли ми досягаємо точки В (рис. 4.1.2) і з'являється перша крапля рідини, найважчі молекули - це ті, які переважно переходять до цієї першої крихітної крапельки рідкої фази. Для «важких» молекул, враховуючи вибір, бажано перебувати в конденсованому стані.
Оскільки ми продовжуємо утворювати більше рідини (стисненням), в основному легкі молекули залишаються в паровій фазі. Однак в кінцевій точці переходу (точка С на рис. 4.1.2) ми змусили всіх перейти в рідкий стан — у них більше немає вибору. Це примусове виконання вимагає більшого тиску. Якщо порівняти зразок рідини в умовах точки роси (точка В на рис. 4.1.2) з зразком, взятим в середині переходу, то зрозуміло, що перший був би багатшим важкими компонентами, ніж другий. Властивості найважчого компонента були б найбільш впливовими в точці роси (коли вперше з'являється рідина); тоді як властивості більш легкого компонента будуть найбільш впливовими в точці міхура (коли останній міхур ось-ось зникне.)
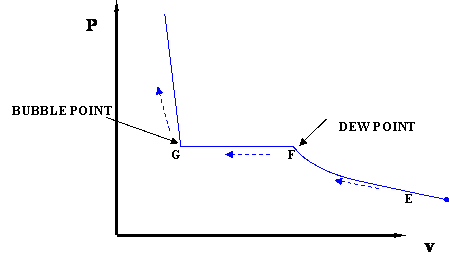
У двофазної області тиск збільшується в міру проходження системи від точки роси до точки міхура. Склад рідини і пари змінюється; але — будьте уважні! — загальна композиція завжди однакова! У точці роси склад пари дорівнює загальному складу системи; однак нескінченно мала кількість рідини, яка конденсується, багатша менш летючим компонентом. У точці міхура склад рідини дорівнює складу системи, але нескінченно мала кількість пари, що залишається в точці міхура, багатша більш летючим компонентом, ніж система в цілому.
Взагалі, коли два різні види змішуються, деякі види поведінки окремих видів та їх властивості зміняться. Їх звичайна поведінка (як чисті компоненти) буде змінено як наслідок створеного нового поля молекулярних взаємодій. Перебуваючи в чистому стані, молекули взаємодіють лише з подібними молекулами. З іншого боку, в суміші відбуваються нові взаємодії між різнорідними молекулами.
Наш наступний крок, щоб продовжити цю дискусію послідовно, полягає в тому, щоб намалювати повну діаграму P-V для цієї бінарної суміші шляхом окреслення двофазної області. Точно так само, як ми робили раніше, окреслюємо двофазну область, намалювавши повне сімейство ізотерм на діаграмі P-V. Малюнок 4.1.3 ілюструє це.
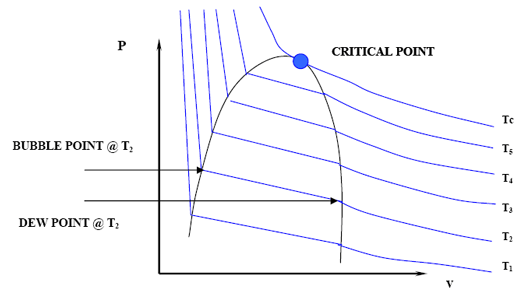
Знову ж таки, лінія, що з'єднує всі точки міхура та роси, буде генерувати криву міхура та точки роси, обидві з яких зустрічаються у критичній точці. Зверніть увагу, що критична точка не представляє максимуму на P-V діаграмі суміші. Також зверніть увагу, що тиск точки міхура та тиск точки роси вже не однакові.
Знову ж таки, ізотерми через двофазну область не горизонтальні, а мають певний нахил. Це повинно мати підтекст. Насправді, це так і є. Що робити, якщо ми зараз хочемо побудувати діаграму P-T для цієї суміші? Чи буде у нас тільки одна лінія, де криві міхура і точки роси лежать один на одному, як це було для однокомпонентної системи? Звичайно, ні. Замість того, щоб обидві криві були разом, крива точки міхура зміститься вліво вгорі (більш високий тиск), а крива точки роси зміститься в нижнє праворуч (нижній тиск) - обидва вони зустрічаються в критичній точці. На малюнку 4.1.4 показана типова фазова оболонка для суміші.
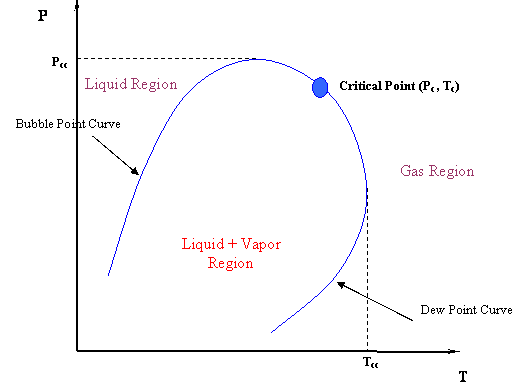
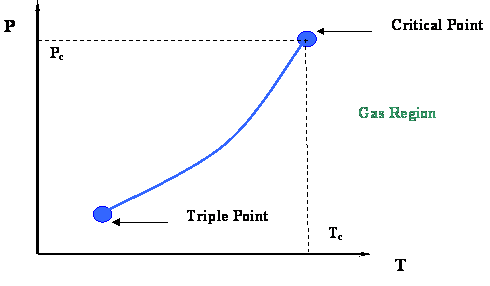
Зверніть увагу на величезну різницю між P-T кривої багатокомпонентної системи (двійкова система в даному випадку, рис. 4.1.4) і кривою P-T чистої (одиночної) складової (рис. 3.1.1 модуля 3, повторюється нижче). Єдина система, для якої крива точки міхура буде збігатися з кривою точки роси, - це однокомпонентна система, де ми маємо єдину лінію для діаграми P-T (наприклад, крива точки кипіння, представлена на рис.3.1.1). На рис. 3.1.1 критична точка являє собою максимальну сукупність (P, T) значень, які ви могли б знайти на графіку P-T.
Це ще не все. Є й інші наслідки. Чи можемо ми зараз сказати, що критична точка - це максимальне значення тиску і температури, де рідина і газ можуть співіснувати? Подивіться ще раз на рисунок 4.1.4. Очевидно, що ні. Критична точка більше не знаходиться на вершині або піку двофазної області; отже, пара і рідина можуть співіснувати в рівновазі при T > T c і P > P c. Насправді ми можемо виділити два нових максимуми: умова P cc - максимальний тиск, а умова T cc - максимальна температура, при якій L+V буде знаходитися в рівновазі. Привласнюємо цим пунктам особливі назви. Існують cricondenbar і cricondentherm відповідно.
Зрозуміло, що єдине визначення, яке зараз може триматися для критичної точки - як для сумішей, так і для чистих компонентів - це те, що показано нижче.
Критична точка (P c, T c):
Температура і тиск, при якому рідина і пара не відрізняються.
Знову ж таки, це визначення застосовується як для сумішей, так і для чисто компонентних систем; воно не робить жодних посилань на максимальні значення в кривій. Ці максимальні значення, як ми вже говорили, мають особливі назви у випадку сумішей. Таким чином, для сумішей ми повинні додатково визначити:
Тепловий конденсатор (Т куб.см):
- Найвища температура в двофазної оболонці.
- Для T > T cc рідина і пара не можуть співіснувати в рівновазі, незалежно від тиску.
Конденсатор (P cc):
- Найвищий тиск в двофазної оболонці.
- Для P > P cc рідина і пара не можуть співіснувати в рівновазі, незалежно від температури.
У випадку з унарною системою, крім кривих точки роси і бульбашок, що лежать один на одному, зрозуміло, що cricondentherm, cricondentherm і критичні умови також представлені однією точкою (тобто самої критичною точкою). Це зрозуміло з усіх трьох попередніх визначень. Таким чином, як ми бачили раніше, визначення критичної точки в унарних системах охоплює всі три визначення, наведені вище.
Тільки для чистих речовин:
Cricondentherm = Критична температура = Критична точка.
