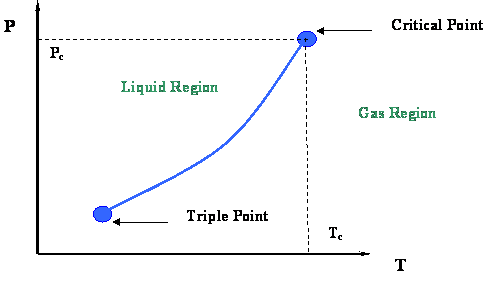
3.1: Крива тиску пари
З останнього модуля ви згадаєте, що досліджували криву тиску пари (рис. 2.2.3) і її кінцівки. Ця цифра представлена в цьому модулі на малюнку 3.1.1. Зроблено висновок, що дві дуже важливі термодинамічні точки пов'язують криву тиску пари: критичну точку на її верхньому кінці та потрійну точку на її нижньому кінці.
Тепер давайте по-друге подивимося на цю цифру. Ми можемо краще зрозуміти інформацію, представлену кривою тиску пари, подивившись на процес ізобарного нагрівання. Це проілюстровано лінією ACB на малюнку 3.1.2. Термін «ізобарний» відноситься до процесу постійного тиску. Під ізобаричним процесом нагрівання ми маємо на увазі «постійне додавання тепла під тиском в систему».
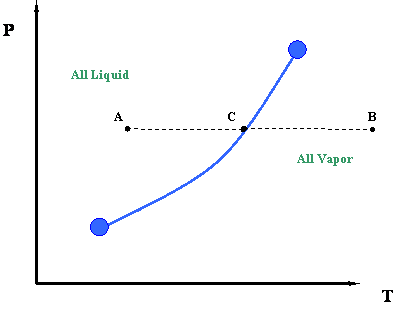
Такий процес можна описати наступним чином. Починаючи з точки А і рухаючись до точки С при постійному тиску, додаємо тепло в систему. Додаючи це тепло, ми викликаємо підвищення температури в системі (Температура при С > Температура при А). У точці С, яка лежить вище кривої тиску пари або температури кипіння, ми стикаємося зі зміною фази. Зліва від точки С, при більш низьких температурах, існує тільки рідина. Праворуч від точки С, при більш високих температурах, є тільки пар. Тому різкий розрив щільності існує в точці С. Під час цього переходу від рідини до пари ми помітимо, що тепло, яке ми додаємо в систему, не викликає ніякого підвищення температури, а насправді температурні і напорні умови залишаються постійними під час переходу представлена кривою пари. Іншими словами, навіть якщо ми додаємо тепло, система залишається під тиском і температурою, пов'язаними з точкою С, поки не відбудеться весь фазовий перехід - тобто, поки вся пара не перетвориться в рідину. Замість того, щоб працювати над підвищенням температури рідини, це тепло служить для переміщення молекул рідини один від одного, поки вся рідина не стане парою.
До цього моменту ми бачили, що тепло, додане до того, як система досягла фазового переходу, використовувалося для підвищення температури речовини. Однак тепло, яке ми додаємо прямо зараз, під час фазового переходу, не викликає жодного підвищення температури (отже, це, як кажуть, приховане тепло або прихована теплота випаровування). Тому ми розрізняємо два види тепла: відчутне тепло і приховане тепло.
- Розумне тепло: Його основне призначення - викликати підвищення температури системи.
- Приховане тепло: Він служить лише одній меті: перетворити рідину в пару. Він не викликає підвищення температури.
Насправді назва «латентний» передбачає «прихований». Тут ми додаємо тепло в систему, але не бачимо його ефекту з точки зору підвищення температури. Тепло, необхідне для перетворення одного моля насиченої рідини в пару, відоме як прихована молярна теплота випаровування:(Δ˜Hvap)
Після того, як ми перетворили всю рідину в пару (тобто ми подали все необхідне приховане тепло для цього), ми можемо продовжувати додавати більше тепла. Якщо ми це зробимо, температура знову підвищиться, і ми закінчимо в точці В (рис. 3.1.2). Це тепло також є розумним, оскільки воно спричиняє підвищення температури системи.
Цікаво відзначити, що для того, щоб змінити процес від точки В до точки А, нам доведеться видалити точну кількість тепла, яке ми додавали раніше. Це основний наслідок принципу енергетичного балансу. Такий зворотний процес ми називаємо ізобаричним процесом охолодження. Нам доведеться видалити деяке розумне тепло, щоб охолодити пар з точки В до С, а потім ми видалимо все приховане тепло пари, щоб конденсувати його в рідину (перехід в точці С). Нарешті, нам також потрібно буде видалити більш розумне тепло з системи для охолодження рідини з точки С в точку А.
У попередніх двох процесах, від А до В або навпаки, нам довелося перетинати фазову межу, представлену кривою тиску пари. Однак це не єдиний термодинамічний шлях, який доступний нам для переходу від А до Б. Рисунок 3.1.3 зображує інший можливий шлях.
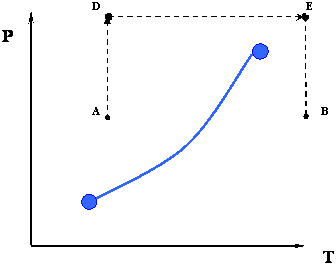
Замість того, щоб робити весь процес ізобарно, ми можемо розробити новий шлях, який також може досягти мети прийняття системи від умови 'A' до умови 'B'. Розглянемо шлях ADEB, який зображений на малюнку 3.1.3.
Послідовність шляхів
- Шляхи AD: Ізотермічне стиснення
- Шляхи DE: Ізобарний нагрів
- Шляхи EB: Ізотермічне розширення
У цьому новому шляху є щось чудове. На відміну від попереднього шляху, зверніть увагу, що ми взагалі не перетинаємо межу фаз. Наслідки прийняття цієї нової дороги можуть здатися дивовижними на перший погляд: ми перейшли від все-рідкого стану (точка А) до стану все-пари (точка B) без будь-якого різкого фазового переходу. Насправді, уздовж шляху ADEB немає фазового переходу, тому що ми ніколи не перетинали межі фази. Оскільки межа фази являє собою різкий розрив щільності (та інших фізичних властивостей), той факт, що ми не перетинаємо її, говорить нам про те, що, як ми йдемо, насправді існує градація щільності (від рідини подібної, або високої щільності в точці А до газу, як, або низької щільності в точка В) замість різкої зміни від високої щільності рідини до низької щільності газу.
Ми змогли це зробити, тому що ми пішли вище критичних умов. У безпосередній близькості від критичних умов і поза ними ми більше не можемо чітко позначити однофазний стан як «рідина» або «газ». За цих умов будь-який перехід відбувається поступово без будь-якої диференціації між «рідкою» та «газовою» фазою. Ми називаємо цю рідину, яку ми не можемо визначити ні як рідину, ні як газ, надкритичною рідиною. З точки зору щільності надкритична рідина може бути описана одночасно як легка рідина (її щільність не така висока, як щільність рідини) і важкий газ (його щільність не така низька, як типова газова щільність даної речовини). Поведінка рідини навколо цієї області є активним і цікавим напрямком сучасних досліджень.
Підсумовуючи, для чистої речовини ви можете уникнути різкого фазового переходу (наприклад, описаного шляхом ACB), обходячи критичну точку (шлях ADEB). Майте на увазі, що будь-який шлях, який перетинає криву тиску пари (ACB), зазнає фазового переходу.
