2.2: Чисто компонентні системи
Почнемо з відомої однокомпонентної системи: вода — найбагатша речовина на землі. Яка поведінка води при різних умовах тиску і температури? Або ще більш конкретно, чи є єдина відповідь на питання: яка температура кипіння води? Більшість людей сказали б «звичайно, 100° C», але більш точна відповідь поставила б уточнююче питання: «При якому тиску?» Загальновідомо, що вода кипить при 100° C (212° F) при атмосферному тиску. Вимагаючи специфікації тиску, щоб однозначно визначити температуру кипіння води, ми визнаємо, що температура кипіння чистої речовини залежить від тиску. Насправді ми також неявно застосовуємо дуже корисний термодинамічний принцип - Правило Гіббса, але це буде темою для подальшого обговорення.
У термодинаміці ми називаємо Нормальну температуру кипіння як температуру кипіння рідини при 1 атм тиску (тобто атмосферному тиску). Отже, 100° C (212° F) є нормальною температурою кипіння води.
Що робити, якщо ми хочемо донести цю ідею? Ми хотіли б повідомити поняття, що температура, при якій закипає вода, змінюється в залежності від тиску. А як щодо зображення для представлення цієї інформації? Ось наша перша діаграма стану, рис. 2.2.1. У той час як для опису мінливості температури кипіння води може знадобитися кілька речень, єдиний рядок, показаний на малюнку 2.2.1, є адекватним. Про що нам говорить Малюнок 2.2.1? Це говорить нам про те, що температура кипіння рідини збільшується зі збільшенням тиску. Іншими словами, це говорить про те, що тиск пари рідини збільшується з підвищенням температури. Цього слід очікувати, оскільки з підвищенням температури більше рідких молекул здатні виходити в парову фазу, тим самим збільшуючи тиск, який агрегат усіх молекул пари чинить на систему (тобто тиск пари).
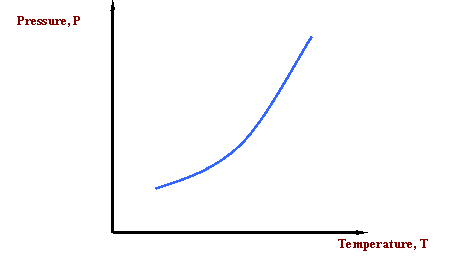
Крива на малюнку 2.2.1 називається кривою тиску пари або кривою точки кипіння. Лінія також представляє криву точки роси та криву точки міхура; одна над іншою. Ця крива являє собою перехід між паровим і рідким станами.
Визначення основних термінів
Тиск пари: Тиск, який парова фаза рідини чинить над власною рідиною при рівновазі при заданій температурі.
Точка роси: Тиск і температурний стан, при якому нескінченно мала кількість рідини (крапелька) існує в рівновазі з парою. Він являє собою стан початкового утворення рідини в спочатку газоподібній системі. Зверніть увагу, що його також можна візуалізувати як «рідку систему», де випаровується вся, крім нескінченно малої кількості рідини.
Точка міхура: Тиск і температурний стан, при якому система вся рідка, і в рівновазі з нескінченно малою кількістю (бульбашкою) газу. Ця ситуація, по суті, протилежна ситуації точки роси.
Примітка:
Для однокомпонентних систем одна крива представляє всі три з цих умов (тиск пари, точки роси та умови точки міхура) просто тому, що тиск пари = точка роси = точка міхура для унарних систем.
На малюнку 2.2.1 після вибору тиску насичення існує одна (і тільки одна) температура насичення, пов'язана з ним. Це справедливо лише для однокомпонентної системи. Іншими словами, це єдина температура (при заданому тиску), при якій рідка і газова фаза будуть співіснувати в рівновазі. Правило, яке регулює унікальність цієї точки, для однокомпонентної системи називається правилом фази Гіббса. Це другий раз, коли ми згадуємо це правило, вказуючи на його велике значення у фазовій поведінці. Відкладемо будь-яке детальне обговорення правила фази Гіббса на потім.
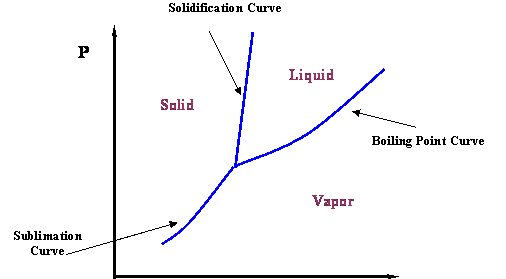
Крива пари, показана на малюнку 2.2.1, являє собою перехід між паровим і рідким станами для чистого компонента. Очевидно, що це ще не вся історія. Якщо ми охолоджуємо рідинну систему, має сенс очікувати утворення льоду (твердої фази). Ми можемо повідомити цю нову ідею, додавши більше інформації до малюнка 2.2.1. По суті, існує лінія, яка визначає перехід рідина-тверде тіло; вона називається кривою затвердіння (або плавлення) (див. Рис. Крім того, незважаючи на те, що це неінтуїтивно, можна перейти від твердого до пари, не проходячи через рідкий стан, якщо тиск досить низький. Цю інформацію можна додати до діаграми, включивши криву сублімації. Таким чином, малюнок 2.2.2 являє собою більш повну фазову діаграму для чистокомпонентної системи.
Подивіться, як все більше інформації можна представити в межах фазової діаграми. Як інженери з нафти та природного газу, ми зосереджуємо свою увагу на кривій точки кипіння, оскільки вона являє собою перехід між рідиною та газом, фазами, з якими ми маємо справу найчастіше. Зосередимо на ньому свою увагу.
На малюнку 2.2.3 представлена діаграма P-T, що представляє криву тиску пари та її кінцівки. Дві дуже важливі термодинамічні точки зв'язали криву тиску пари: Критична точка на її верхньому кінці і Потрійна точка на її нижньому кінці.
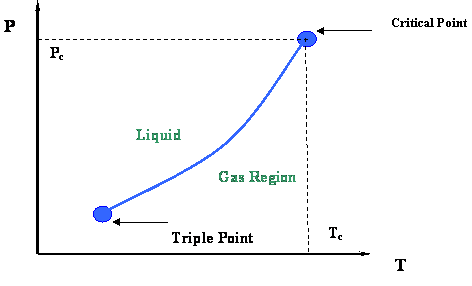
Потрійна точка є місцем зустрічі кривих тиску пари, затвердіння і сублімації (див. Рис. 2.2.2); отже, вона являє собою єдину умову, при якій всі три фази чистої речовини (тверда, рідина і газ) можуть співіснувати в рівновазі.
У критичній точці газ і рідина знаходяться в рівновазі без будь-якого інтерфейсу для їх диференціації; вони більше не помітні за своїми властивостями. Як ми пам'ятаємо, єдине місце на діаграмі P-T, де рідина і газ можна знайти разом в рівновазі, - це вздовж кривої тиску пари. Значить, критична точка - це явно максимальне значення температури і тиску, при якому рідина і пара можуть перебувати в рівновазі. Ця максимальна температура називається критичною температурою (T c); відповідний максимальний тиск називається критичним тиском (P c).
Завершимо цей перший модуль виділенням найважливіших властивостей критичної точки чистих речовин, як показано нижче. Наступний модуль буде надавати більш детальну інформацію, що цікавить, які вбудовані на рис. 2.2.3.
Властивості критичної точки (T c, P c) (для чистих речовин):
- Температура і тиск, для яких рідина і пара вже не помітні.
- Для T > T c рідина і пара не будуть співіснувати, незалежно від того, який тиск.
- Для P > P c рідина і пара не будуть співіснувати, незалежно від температури.
