1.4: вуглець
- Page ID
- 32604
Через важливість CO 2 як парникового газу вуглецевий цикл є вирішальною частиною кліматичної системи. Оскільки вуглецевий обмін з біосферою, біологічні процеси потрібно враховувати в науці про клімат. Вуглецевий цикл є частиною більш широких біогеохімічних циклів, які включають інші біологічно важливі хімічні елементи, такі як азот і кисень.
Природний вуглецевий цикл
Вуглець обмінюється відносно швидко між трьома великими резервуарами: океаном, атмосферою та сушею (рис. 1). З них в океані міститься найбільше вуглецю: майже 40 000 Pg. Велика частина вуглецю в океані знаходиться у формі розчиненого неорганічного вуглецю (DIC), і більшість ДВС знаходиться в проміжному та глибокому шарах здебільшого просто тому, що ці глибини складають більшу частину його обсягу. Морська біота важлива для перенесення вуглецю з поверхні в глибокий океан, але їх біомаса дуже мала, оскільки вони складаються в основному з мікроскопічних водоростей, які називаються фітопланктоном. Фітопланктон будує основу харчової павутини океану за допомогою фотосинтезу. Вони пристосувалися бути крихітними і легкими, щоб не опускатися на морське дно. Їм потрібно перебувати біля освітленої сонцем поверхні для фотосинтезу. Рівень освітленості глибини нижче близько 100 м стає занадто низьким через поглинання морською водою. Глибокий океан, отже, темний, але органічна речовина занурюється туди з поверхні в різних формах, наприклад, як фекальні гранули зоопланктону. Нижче поверхні потопаюча мертва органічна речовина передихається бактеріями і повертається в басейн неорганічного вуглецю. Це називається біологічним насосом, оскільки він видаляє вуглець з поверхні та атмосфери та секвеструє його в глибокому океані, де він може перебувати протягом сотень до тисяч років. Розчинений газ CO 2 в морській воді є частиною басейну DIC. Він обмінюється з атмосферою близько 80 Пг вуглецю на рік. Газообмін океану в атмосфері залежить від різниці між поверхневим океаном і парціальним тиском атмосфери (pCo 2; в цій книзі ми використовуємо концентрацію PCO 2 і CO 2 синонімічно в одиницях частин на мільйон або проміле) і тому призводить до сильного і відносно швидкого зчеплення атмосферної концентрації CO 2 з поверхневим океаном.
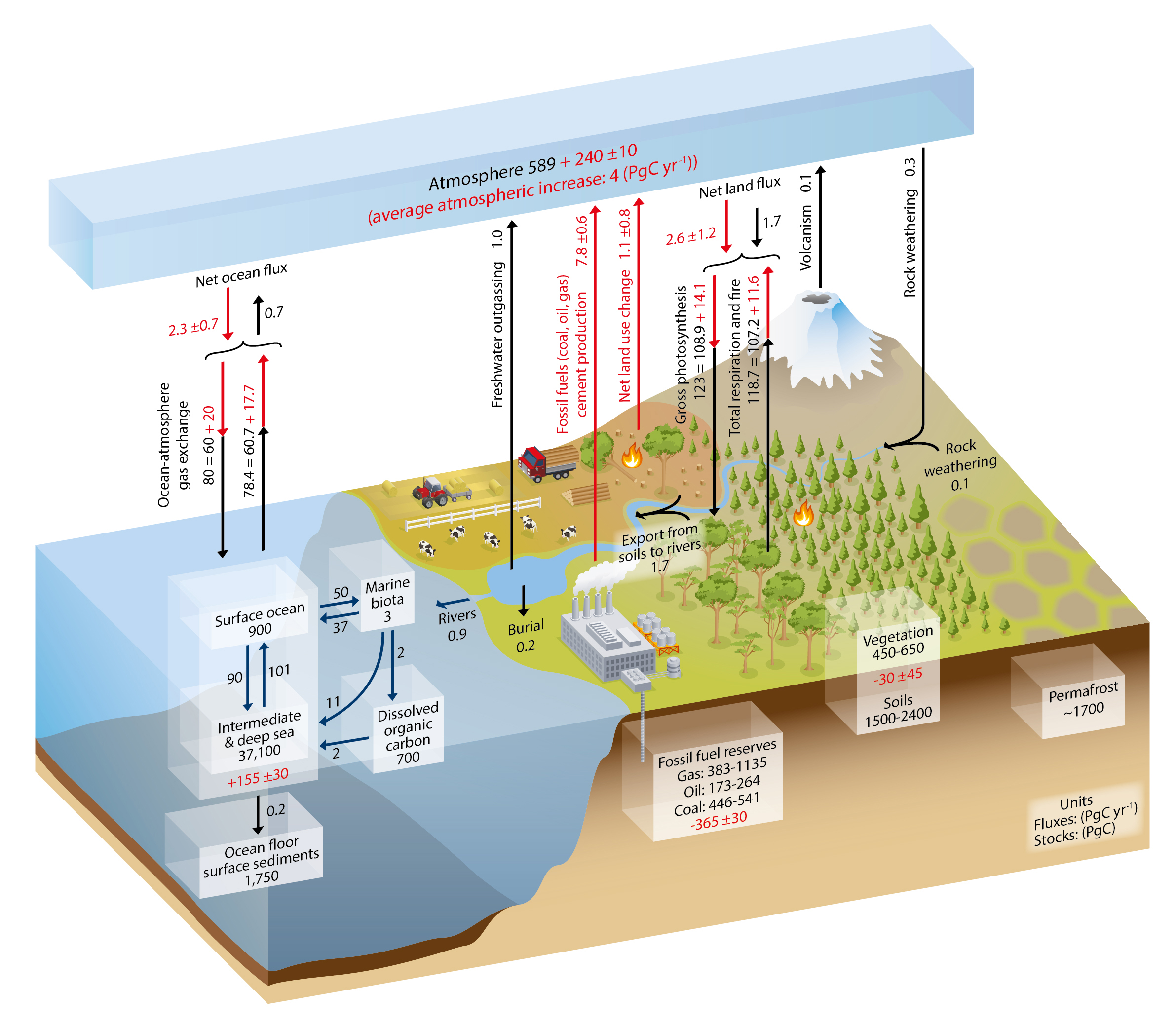
Другим за величиною з трьох швидко обмінюваних вуглецевих резервуарів є земля, яка містить близько 4000 Pg вуглецю. На суші вуглець зберігається і в живій рослинності, в грунтах, і в вічній мерзлоті. Оскільки наземні рослини не мають проблеми зануритися зі світла, вони можуть рости великими і містити велику кількість вуглецю, наприклад, дерева. Тому набагато більше вуглецю зберігається в живій біомасі на суші (~ 500 Pg), ніж в океані (~ 3 Pg). Однак ще більше вуглецю зберігається в грунтах і вічній мерзлоті.
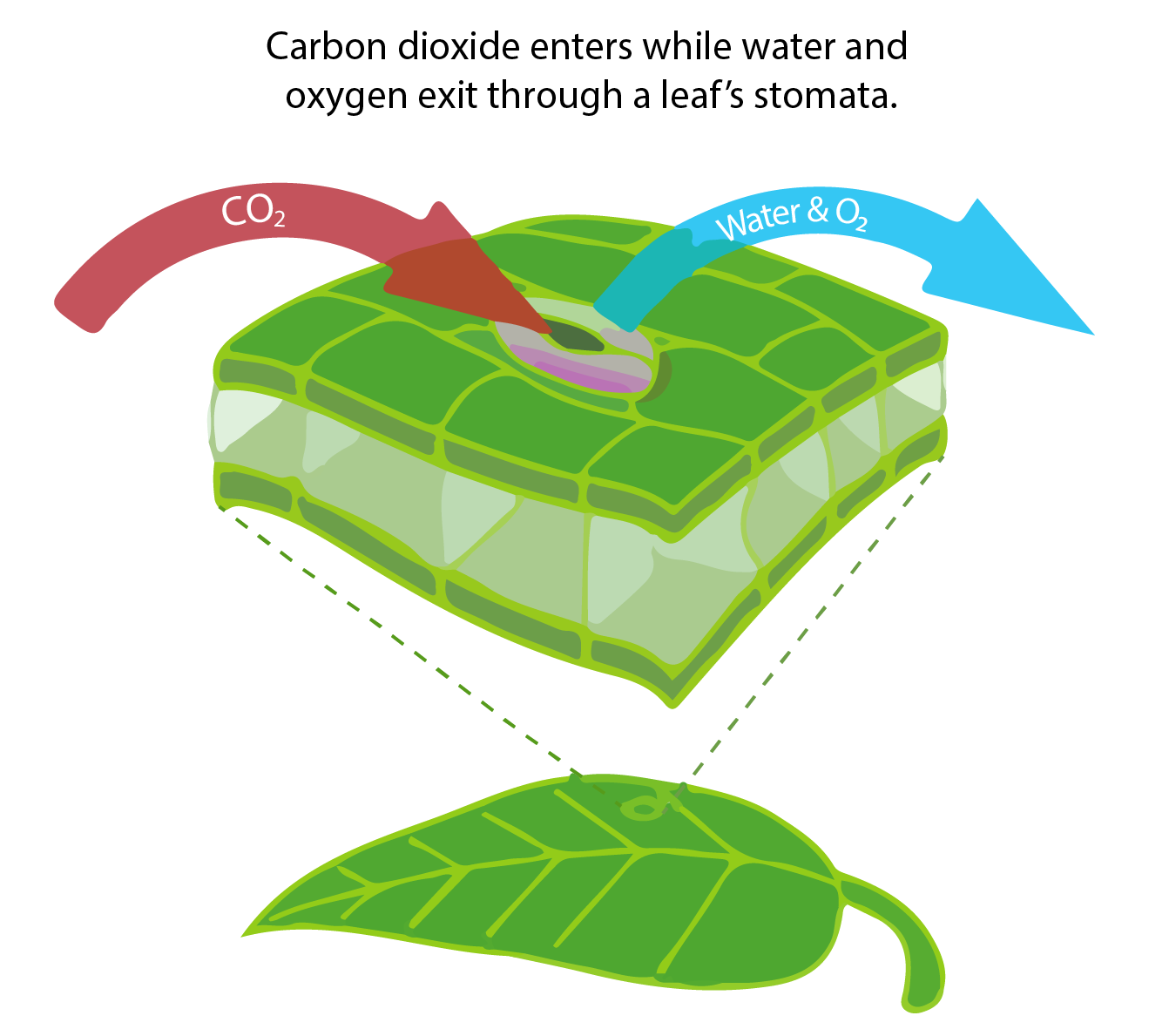
Більше 100 Пг вуглецю щороку видаляються з атмосфери шляхом фотосинтезу наземних рослин і перетворюються в органіку. Органічна речовина циклічно проходить через наземну харчову павутину і в кінцевому підсумку потрапляє в ґрунтовий вуглецевий басейн, де вона розкладається. Як і в океані, бактерії та гетеротрофні організми на суші вдихають органічний вуглець і перетворюють його назад в неорганічний СО 2. Поглинання та викид вуглецю на суші не сильно залежить від атмосферних концентрацій CO 2. Вони більше залежать від наявності води і температури відповідно. Ріст рослин на суші сильно обмежений водою і показники дихання сильно залежать від температури. Однак СО 2 підвищує ефективність використання води наземних рослин, оскільки при більш високих концентраціях CO 2 їм не потрібно відкривати продихи так само, як при більш низьких концентраціях CO 2. Продихи - це невеликі отвори в клітині, які дозволяють CO 2 потрапляти, але вони також дозволяють воді йти в процесі, який називається транспірацією (див. Малюнок у вікні нижче). Таким чином, при більш високих рівнях CO 2 рослини можуть рости більше за однакову кількість використання води.
Резервуар атмосферного вуглецю відносно невеликий порівняно з океаном, який в ~ 40 разів більше, і сушею, яка в ~ 10 разів більше. Однак атмосфера має вирішальне значення для зв'язку суші та океану за допомогою швидких обмінів.
Вставка 1: Фотосинтез і дихання
Фотосинтез (рис. B1.1) - це процес, за допомогою якого автотрофні організми (рослини, водорості та багато бактерій) виробляють органічну речовину та кисень з СО 2 та води, використовуючи світло як джерело енергії.

Малюнок B1.1: Хімічна реакція на фотосинтез. Вуглекислий газ і вода перетворюються на вуглеводи і кисень. Цей процес використовує енергію.
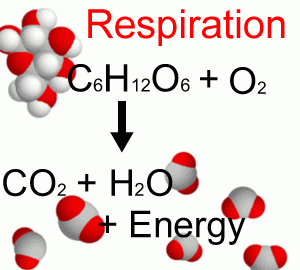
Дихання (рис. B1.2) - це зворотний процес, за допомогою якого гетеротрофні організми (бактерії, гриби, тварини та люди) окислюють органічні вуглеводи, отримуючи їх енергію, що призводить до CO 2 та води.
Для фотосинтезу наземні рослини повинні забирати СО 2 з повітря. Вони роблять це, відкриваючи маленькі пори, звані продихами, через які може потрапляти не тільки СО 2, але і вода і кисень можуть вийти з клітини (рис. B1.3).
Антропогенний вуглець
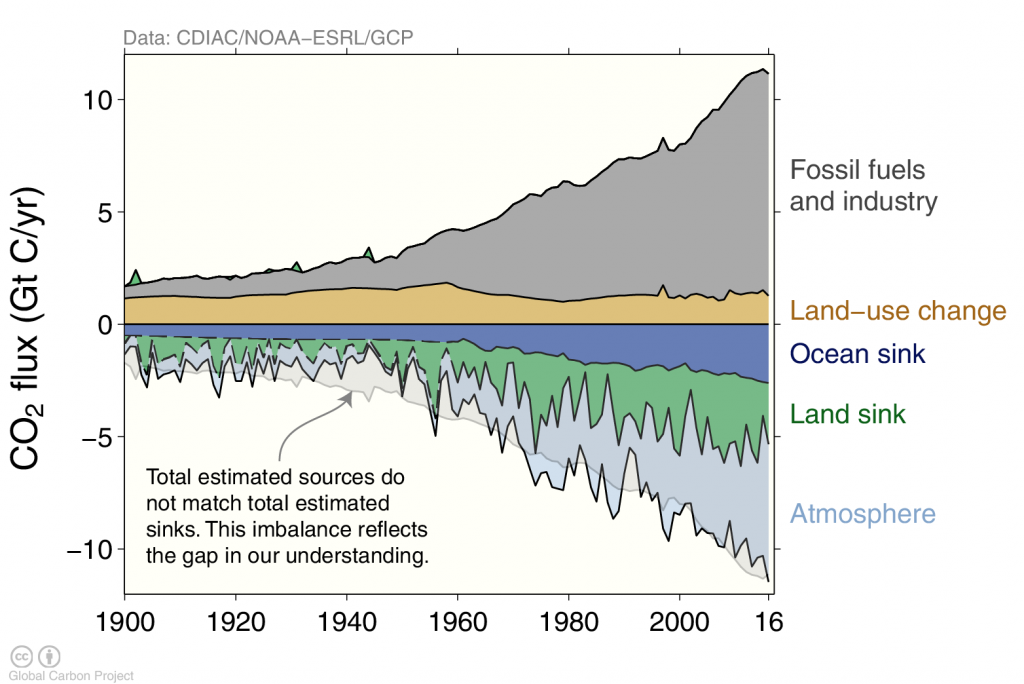
Вплив людини на глобальний вуглецевий цикл був відносно обмеженим до промислової революції, хоча деякі викиди від змін землекористування, таких як вирубка лісів, можливо, тривають протягом сотень або тисяч років. Однак протягом останніх 100 років швидке спалювання викопних палив, таких як вугілля, газ та нафта, спричинило масове збурення (рис. 2). Це збурення, мабуть, найбільш очевидне в атмосфері, де концентрації CO 2 збільшилися більш ніж на 40%. У розділі 3 ми бачили, що нинішні рівні атмосферного CO 2 були безпрецедентними протягом останніх 800 000 років, але реконструкції, що йдуть далі в часі, свідчать про те, що останній раз атмосфера Землі мала близько 400 ppm CO 2 приблизно 3 мільйони років тому.
В даний час люди викидають близько 10 мільярдів тонн вуглецю в атмосферу на рік в основному від спалювання викопного палива (~ 90%). Однак вирубка лісів продовжує залишатися значним внеском (~10%). Антропогенні викиди вуглецю від спалювання викопного палива швидко зросли після другої світової війни. Океан зайняв близько 40% (155/395) усіх антропогенних викидів вуглецю досі. 60% (240/395) залишилися в атмосфері, тоді як земля виходить на змив через втрати через вирубку лісів і приріст через недавнє відростання.
Антропогенні викиди вуглецю швидко зросли на початку 2000-х років, але в останні роки вони згладилися (рис. 3) здебільшого через викиди з Китаю показали подібну поведінку (рис. 4).
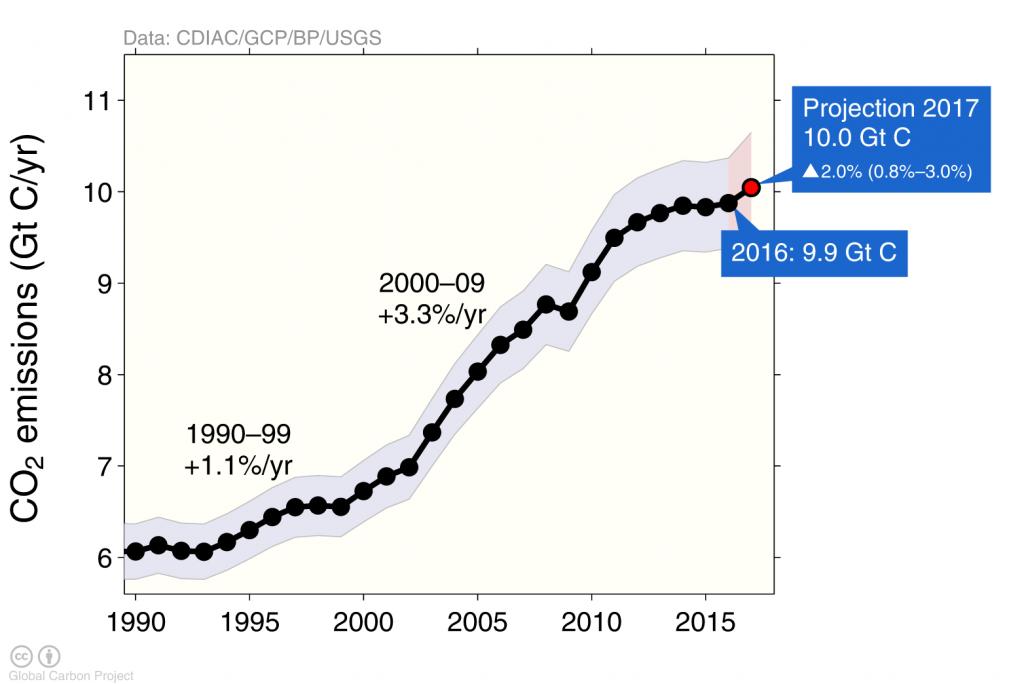
Наслідки фінансово-економічної кризи спостерігаються в падінні глобальних викидів вуглецю в 2009 році, спричиненому скороченням викидів у США та Європі (рис. 4), тоді як викиди продовжували збільшуватися в Китаї до 2013 року, після чого вони залишалися постійними.
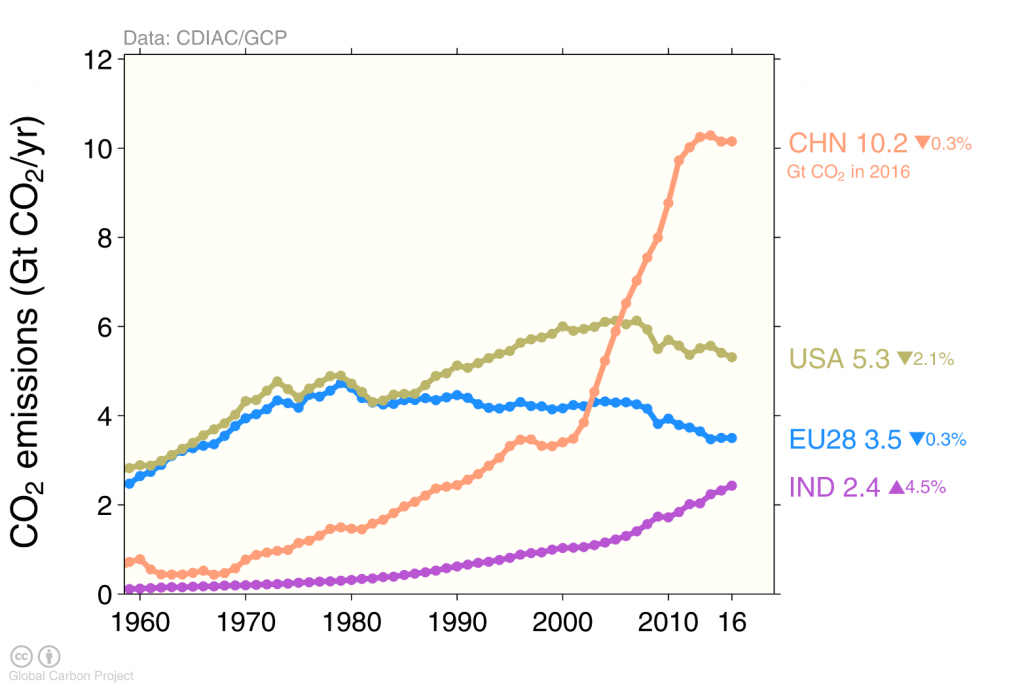
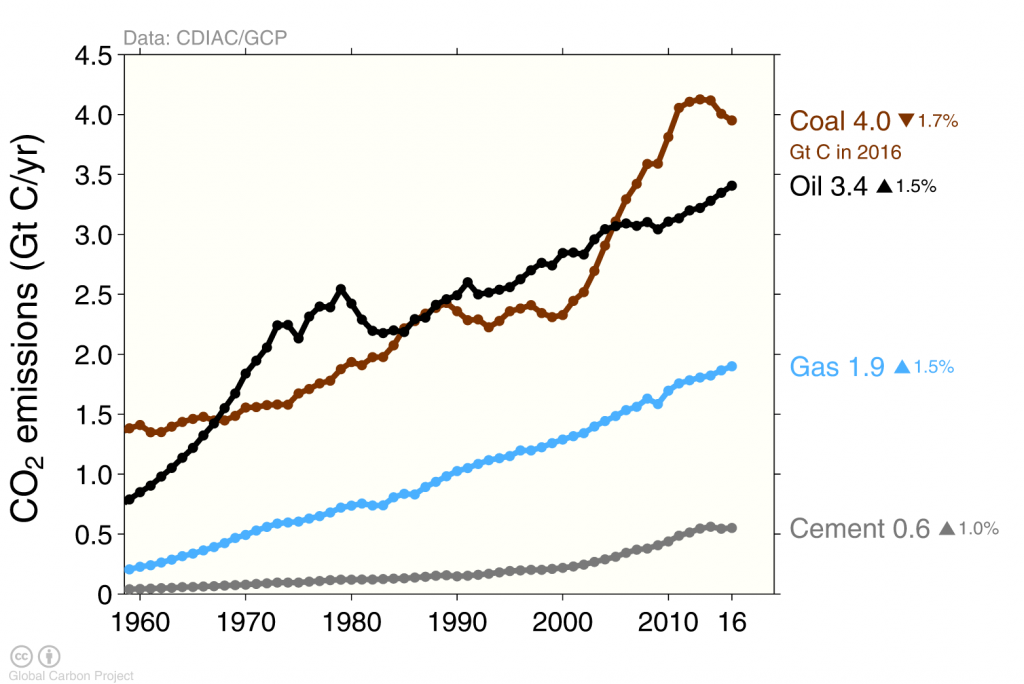
Викиди вуглецю, спричинені людиною, в основному, в результаті спалювання викопного палива, тоді як виробництво цементу сприяє лише близько 6% (рис. 5). Спалювання вугілля, нафти та газу значно зросла за останні 50 років. Збільшення викидів з Китаю протягом першого десятиліття 21-го століття підживлювалося головним чином спалюванням вугілля.
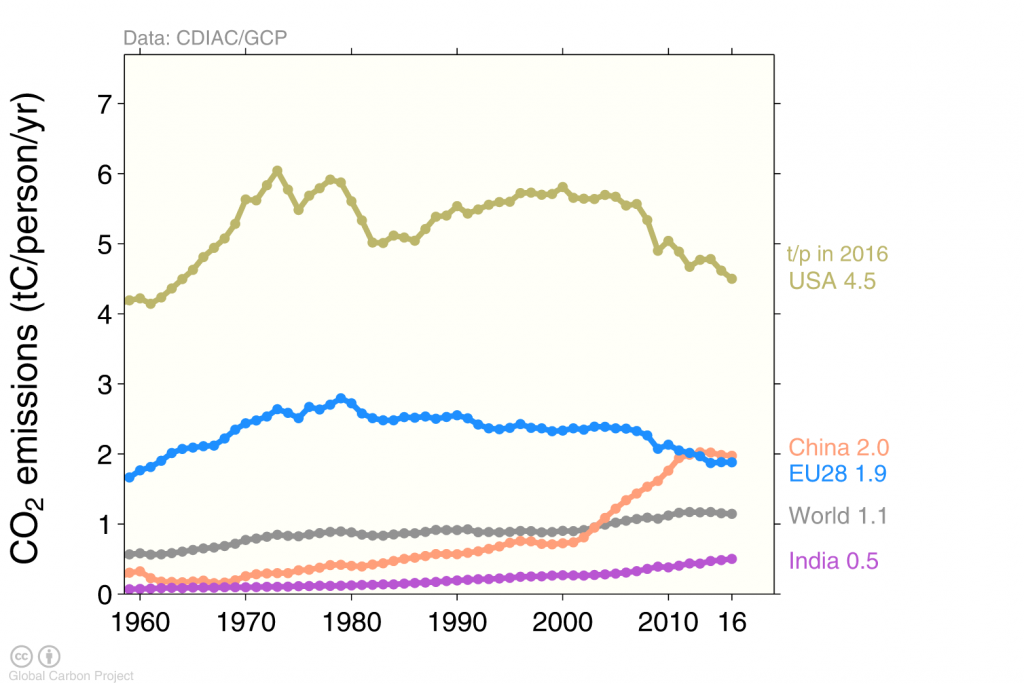
Серед чотирьох найвищих випромінювачів США є найбільшими викидами на людину (рис. 6). Середній американець США щороку викидає близько 5 метричних тонн вуглецю в повітря. Це більш ніж удвічі більше викидів на людину в Європі або Китаї, більш ніж втричі перевищує середні викиди по всьому світу, і приблизно в десять разів більше викидів від людини в Індії.
Як ми знаємо, що зростаючі концентрації CO 2 в атмосфері є наслідком діяльності людини? Існує кілька незалежних ліній доказів. Перший походить від економічних даних. Оскільки викопне паливо торгується на міжнародному рівні, ми знаємо, скільки нафти, вугілля та газу країна імпортує та використовує. Дані, наведені на рис. (2) через (6), базуються на цих оцінках. Затінена область на малюнку (3) вказує на смуги помилок цих оцінок. Не всі країни публікують і роблять свої дані доступними, що призводить до цих невизначеностей. Однак вони відносно невеликі, такі, що викиди, як відомо, в межах приблизно 5% похибки.
Коробка 2: Ізотопи вуглецю
Вуглець існує у вигляді трьох ізотопів. Найбільш поширений вуглець-12 (12 С) з 6 протонами і 6 нейтронами, більш рідкісний вуглець-13 (13 С) з додатковим нейтроном, і вуглець-14 (14 С) або радіовуглець з двома додатковими нейтронами. 14 С є радіоактивним і розпадається з періодом напіврозпаду 5,730 років.

Малюнок B2.1: Ілюстрація атомної структури ізотопів вуглецю. Ядро складається з протонів (червоного кольору) і нейтронів (зеленого кольору). Він оточений електронами (синім).
Рослини і водорості фракціонують ізотопи вуглецю приблизно на 20 ‰ під час фотосинтезу таким чином, що вони переважно займають світло 12 С. Доіндустріальні δ 13 С значення атмосферного CO 2 становили близько -6,5 ‰. Таким чином, вуглець рослин і ґрунту мають δ 13 C значення близько -27 ‰.
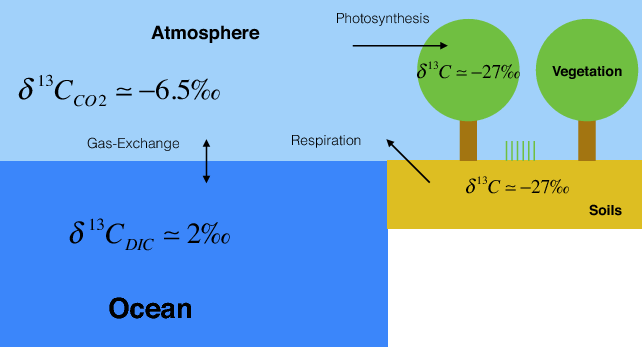
Дельта позначення є аналогічним показу ізотопів кисню, розглянутих у розділі 3. δ 13 C = R/R std - 1, де R = 13 C/ 12 C - співвідношення важкого над легким ізотопом, а R std - це стандарт.
Другий рядок доказів заснований на вимірюваннях ізотопів вуглецю. Фракціонування під час фотосинтезу призводить до того, що рослини і водорості мають дуже виснажені значення δ 13 С (див. Вставка ізотопи вуглецю). Оскільки викопне паливо отримують з древніх рослин, вони також виснажуються ізотопами 13 С. Таким чином, додавання вуглецю з дуже виснаженим сигнатом 13 С в атмосферу призводить до зниження величин δ 13 С атмосферного CO 2. Це спостерігається при вимірах як з навколишнього повітря, так і повітря, витягнутого з крижаних сердечників (рис. 7).
 |
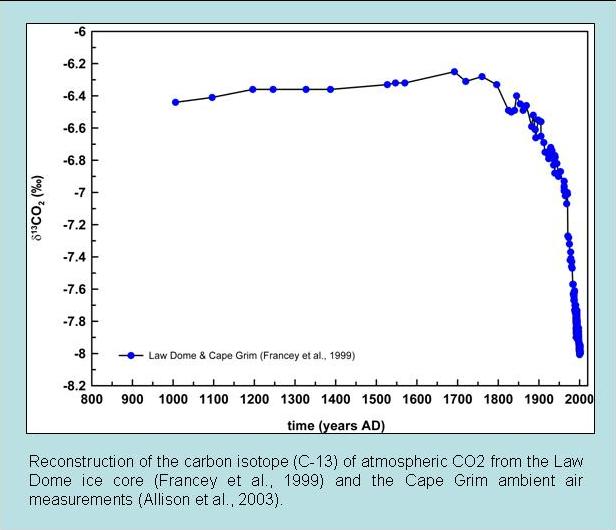
Малюнок 7: Вимірювання ізотопів вуглецю атмосферного CO2. Вгорі: Дані навколишнього повітря з Мауна-Лоа (чорний) та Південного полюса (червоний). Дно: вимірювання крижаного ядра. |
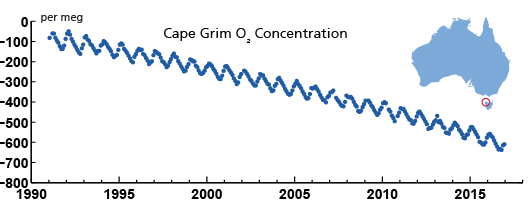
Третій рядок доказів заснований на вимірюваннях кисню в повітрі. Спалювання викопного палива має аналогічне рівняння хімічної реакції, що і дихання. Вуглеводи вступають в реакцію з киснем з утворенням CO 2 і води. Під час цієї реакції виділяється енергія. Таким чином, спалювання вуглеводів витрачає кисень. Вимірюючи співвідношення кисню до азоту в повітрі, можна виявити зміни концентрації кисню в атмосфері, навіть якщо вони невеликі порівняно з абсолютними концентраціями кисню (рис. 8). Ці вимірювання є свідченням масового процесу горіння, що відбувається на Землі прямо зараз.
Ми робимо висновок, що люди спричинили велике збудження природного вуглецевого циклу здебільшого спалюванням викопного палива, що збільшило концентрацію атмосферного CO 2 з 280 ppm до більш ніж 400 ppm, до рівнів, безпрецедентних в історії Землі протягом приблизно 3 мільйонів років. Близько 40% антропогенного вуглецю, що викидається досі, було захоплено океаном, тим самим зменшуючи накопичення CO 2 в атмосфері.
Коробка 3: Час перебування
Час перебування τ речовини у резервуарі - це час, необхідний для повної заміни резервуара з його введенням: τ = X/I = X/O (при рівновазі I = O), де X - розмір резервуара (він же запас, кількість або інвентар) і I (O) - вхідний (вихідний) потік. Див. розділ Бюджетне рівняння в розділі 4.
Вправа: Використовуйте рисунок 1 для обчислення
- для доіндустріального періоду час перебування вуглецю (підказка: підсумувати всі входи або виходи для розрахунку I або O) в
- атмосфера,
- океан,
- земельна ділянка,
- комбінована система океан-атмосфера-земля, і
- час перебування антропогенного вуглецю в об'єднаній системі океан-атмосфера-земля.
Карбонатна хімія та підкислення океану
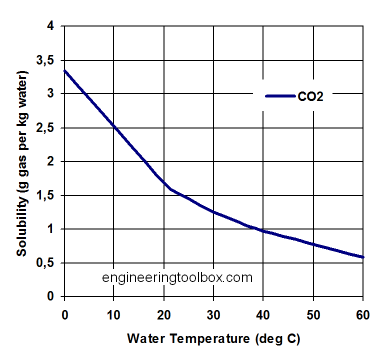
СО 2 надходить в океан з атмосфери через газообмін, якщо парціальний тиск в атмосфері більше парціального тиску в океані. Він розчиняється як газ CO 2 у воді так само, як він розчиняється у вашому содовому напої. Якщо подивитися на нерозкриту пляшку з содою, то бульбашок не видно. Молекули СО 2 виникають у величезній кількості молекул води. Напій розливали під тиском або під холодними температурами. Розчинність CO 2, як і інших газів, таких як кисень, залежить від температури. Більше газу можна розчинити в більш холодній воді (рис. 9). Це причина, чому при розігріванні содового напою він втратить СО 2. Оскільки він не є рідким, СО 2 не «випаровується» у повітря, але виділяє газ. Випаровування має на увазі зміну фаз, яке в даному випадку не відбувається.
В океані СО 2 вступає в реакцію з морською водою з утворенням вугільної кислоти (H 2 CO 3), яка дисоціює на бікарбонатні (HCO 3 -) і карбонатні (CO 3 2-) іони:
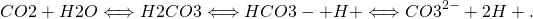
При дисоціації вугільної кислоти на бікарбонат (харчову соду) утворюється іон водню Н +, який збільшує рН води. Більшість іонів водню, однак, повторно поєднуються з карбонатними іонами, утворюючи додаткові бікарбонатні іони. Проте додавання CO 2 до морської води збільшує її концентрацію іонів водню (зменшує його рН) і зменшує концентрацію карбонатних іонів. Цей процес називається закисленням океану.
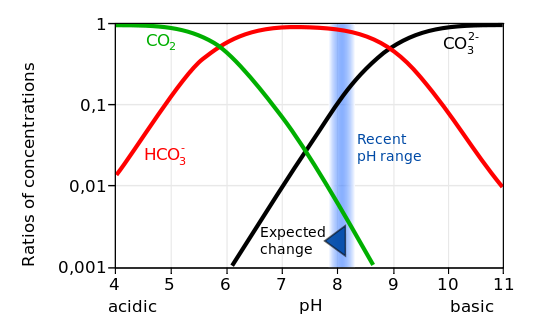
Спостереження показують, що парціальний тиск поверхневих океанських вод уважно стежить за тенденцією атмосферного CO 2 (рис. 11), що вказує на поглинання антропогенного вуглецю. Вимірювання також демонструють, що рН океану зменшується. Дані поблизу Гаваїв показують, що рН знизився приблизно на 0,05 одиниць з 1988 по 2011 рік. Глобальні оцінки свідчать про зменшення на 0,2 одиниці з доіндустріальних часів. Це відповідає зростанню іонів водню ~ 30%.
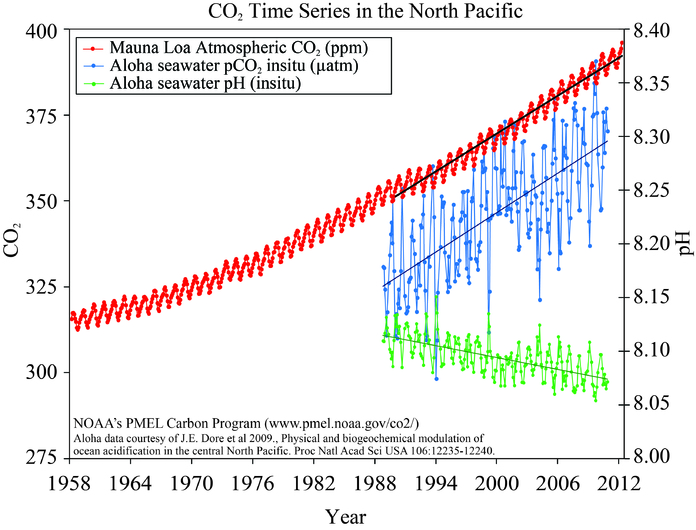
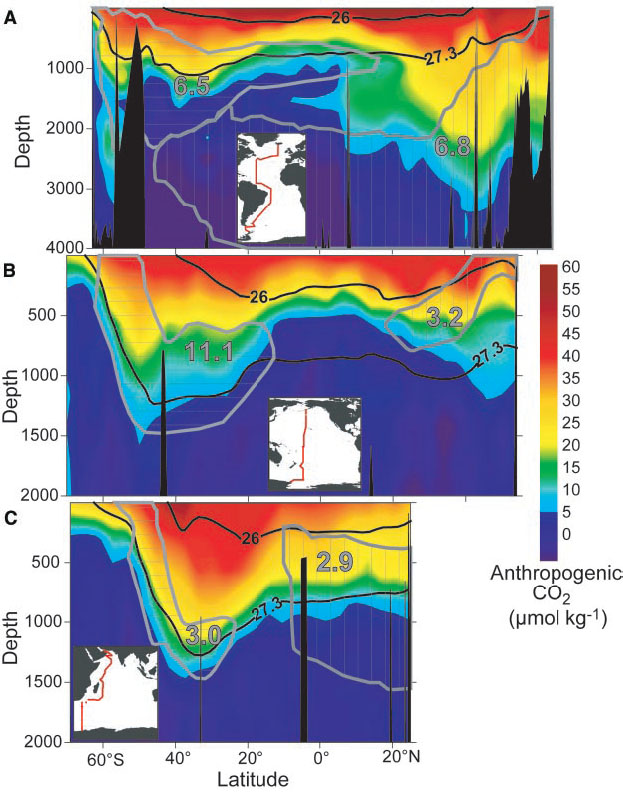
Проникнення антропогенного вуглецю в океан найбільше в Північній Атлантиці, на середніх широтах в Південному океані і в субтропічній північній частині Тихого океану (рис. 12). Як ми побачимо нижче, це регіони конвергенції, субдукції або глибокого водоутворення.
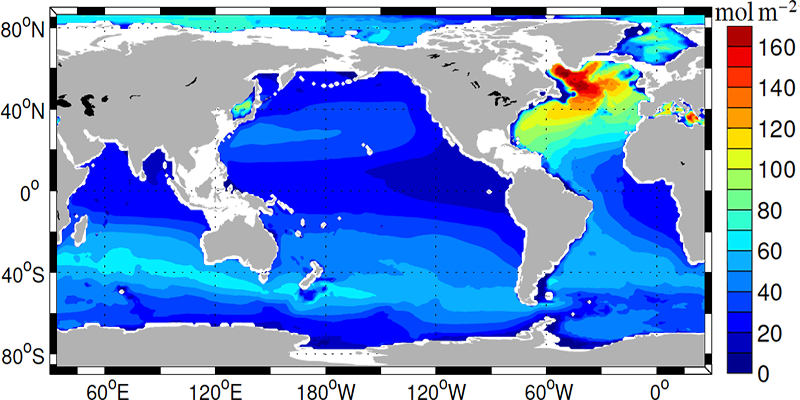
Антропогенний СО 2 потрапляє в океан біля поверхні. Тому найбільше антропогенного вуглецю знаходиться в поверхневих шарах (рис. 13). Однак вимірювані суми проникли на більшу частину верхнього кілометра океану. У деяких регіонах, таких як Північна Атлантика та в Південному океані, антропогенний вуглець увійшов до рівня глибини нижче 2 км. Це регіони океану, де поверхневі води опускаються на великі глибини, беручи з собою антропогенний вуглець.
Кальцифікуючі організми, такі як корали, кокколітофори, форамініфери та птероподи, будують оболонки та інші частини тіла з карбонату кальцію (CaCo 3), використовуючи іони кальцію Ca 2+ та карбонату CO 3 2- (рис. 14).
 |
 |
 |
 |
Зниження концентрації карбонатних іонів та рН знизить стан насичення карбонату кальцію, що ускладнить організмам будівництво оболонок карбонату кальцію. Він також легше розчиняє існуючий карбонат кальцію. Багато вчених стурбовані тим, що нині триваючі зміни в хімії карбонатів океану та очікуваних на майбутнє, у разі продовження антропогенних викидів вуглецю можуть мати несприятливі наслідки для екосистеми океану. Темпи змін, ймовірно, набагато більші за все, що переживали за останні мільйони років, з невідомими ризиками.
Експерименти показують, що підвищення СО 2 або зниження рН може призвести до неправильно сформованих або частково розчинених кокколітів або оболонок птеропод. Однак дослідження підкислення океану все ще знаходяться в зародковому стані, і наслідки для багатьох видів та екосистем наразі не відомі.
Посилання
Сіайс, П., Сабіна, Г. Бала, Л. Бопп, В.Бровкін, Дж. Канаделл, А. Чхабра, Р. DeFries, Дж. Галловей, М. Хайман, C. Джонс, C. Le Quéré, Р.Б. Мінені, С. Піао і П. Торнтон, 2013: Вуглець та інші біогеохімічні цикли. В: Зміна клімату 2013: Основи фізичної науки. Внесок Робочої групи I до П'ятого звіту про оцінку Міжурядової групи з питань зміни клімату [Stocker, T.F., D. Qin, G.-K. Платтнер, М.Тіньор, С.К. Аллен, Дж. Бошунг, А.Науелс, Ю.Ся, В.Бекс і П.М. Мідглі (ред.)]. Cambridge University Press, Кембридж, Великобританія та Нью-Йорк, штат Нью-Йорк, США.
Хатівала, С., та ін. (2013), Глобальне океанічне зберігання антропогенного вуглецю, Біогеологічні науки, 10 (4), 2169-2191, дої:10.5194/bg-10-2169-2013.
Le Quéré, C., et al. (2018), Глобальний вуглецевий бюджет 2018, Земля Syst. Науковий. Дата, 10, 2141—2194, 2018, дої:10.5194/есд-10-2141-2018.
Zeebe, R.E., і D.A. Вольф-Гладро (2001), CO 2 в морській воді: рівновага, кінетика, ізотопи, Elsevier, Амстердам.
Додатковий матеріал

