4.4: Ковалентні зв'язки в Н2 та інших молекулах
Символи Льюїса можуть бути використані, щоб показати, як деякі атоми елементів у лівій частині таблиці лише з одним або двома електронами зовнішньої оболонки можуть втратити ці електрони, утворюючи катіони, такі як Na + або Ca 2 +. Також легко помітити, що атоми з груп поблизу правої сторони періодичної таблиці можуть приймати один або два електрони, щоб отримати стабільні октети і стати аніонами, такими як Cl - або O 2-. Але важко неможливо відібрати більше двох електронів від атома, щоб сформувати катіони із зарядами більше +2 або додати 3 або більше електронів для утворення аніонів із зарядами -3 або навіть більше негативних, хоча іони, такі як Al 3 + та N 3-, існують. Так атоми елементів в середині таблиці Менделєєва і неметали праворуч мають тенденцію ділитися електронами в ковалентних зв'язках, а не ставати іонами.
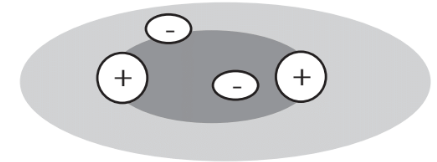
Легко візуалізується, як взаємно притягують іони протилежного заряду утримуються разом в кристалічній решітці. Спільні електрони в ковалентних зв'язках діють на зменшення сил відштовхування між позитивно зарядженими ядрами атомів, які вони з'єднують між собою. Це найлегше помітити у випадку молекули водню, H 2. Ядра атомів Н складаються з одиночних протонів, а два ядра атома Н в молекулі Н 2 відштовхуються один одного. Однак їх 2 спільних електрони складають хмару негативного заряду між двома ядрами Н, захищаючи ядра один від одного відштовхуючи позитивний заряд і дозволяючи молекулі існувати як ковалентно зв'язана молекула (рис. 4.7).